
【题目】氢气用于烟气的脱氮、脱硫的反应:4H2(g)+2NO(g)+SO2(g)![]() N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
A.当v(H2)=v(H2O)时,达到平衡
B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C.使用高效催化剂可提高NO的平衡转化率
D.化学平衡常数表达式为K=![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如图所示,分析判断:(填“OE”、“EF”或“FG”,下同)___段化学反应速率最大,___段收集的二氧化碳气体最多。
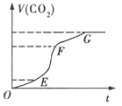
(2)ag块状碳酸钙与足量盐酸反应,碳酸钙消耗的质量随时间的变化曲线用实线表示,在相同的条件下,将bg(a>b)粉末状碳酸钙与足量的相同浓度的盐酸反应,碳酸钙消耗的质量随时间的变化曲线用虚线表示。则图中最符合实际情况的图象是___(填序号)。
A.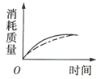 B.
B.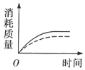 C.
C. D.
D.
(3)为了减缓题述反应的速率,下列措施中,你认为可行的是___(填序号)
A.加入蒸馏水
B.加入氯化钠固体
C.加入硝酸钾溶液
D.加入浓盐酸
E.降温
F.加入MnO2粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
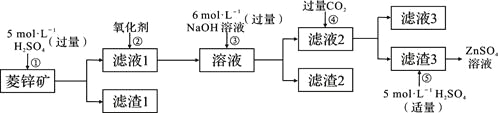
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的___(选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤_____(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式______。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:______________________。
Ⅱ、BaS溶液的制备:
![]()
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:______。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.①④⑧B.②③⑤⑥⑦C.只有①④D.只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列物质:①Al2(SO4)3②Na2CO3③KCl④CuCl2⑤FeSO4溶于水中,对其溶液加热蒸干,仍能得到原物质的是
A. ①③④⑤ B. ②④ C. ①②③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
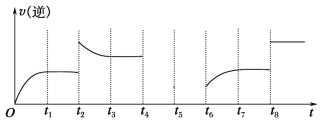
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH_____Na2A溶液的pH(填大于、小于或等于)。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L的KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 _____________。
A.c(H+).c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-) C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(2)常温下,若在0.1mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________ (Ksp[Cu(OH)2]=2.2×10-20)。
(3)将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)![]() H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=____,则H2(g)+I2(g)![]() 2HI(g)平衡常数的表达式为K1=_____(用K表示).
2HI(g)平衡常数的表达式为K1=_____(用K表示).
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为_______,HI的分解率为______。
③能判断该反应达到平衡状态的依据是______
A.容器中压强不变 B.混合气体中c(HI)不变 C.c(I2)=c(H2) D.v(I2)正=v(H2)逆
(4)若该反应800℃达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2mol/L,c(I2)=1mol/L,c(H2)=1mol/L,则该时刻,反应向______(填“正向”或“逆向”,下同)进行,若升高温度,反应向______进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有下列物质:
①HNO3②冰醋酸③氨水④Al(OH)3⑤NaHCO3(s)⑥Cu⑦氯水⑧CaCO3⑨H2CO3⑩盐酸
(1)上述物质中属于强电解质的有__________(填序号),属于弱电解质的有__________(填序号)。
(2)写出下列物质的电离方程式:④__________;⑤__________;⑨__________。
Ⅱ.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的__________(填序号)。
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了![]() 多金属互化物.
多金属互化物.
![]() 某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
![]() 基态
基态![]() 的核外电子排布式 ______ ;配合物
的核外电子排布式 ______ ;配合物![]() 常温下为液态,易溶于
常温下为液态,易溶于![]() 、苯等有机溶剂.固态
、苯等有机溶剂.固态![]() 属于 ______ 晶体.
属于 ______ 晶体.
![]() 铜能与类卤素
铜能与类卤素![]() 反应生成
反应生成![]() 分子中含有
分子中含有![]() 键的数目为 ______ ;
键的数目为 ______ ;
类卤素![]() 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸![]() 的沸点低于异硫氰酸
的沸点低于异硫氰酸![]() 的沸点,其原因是 ______ ;
的沸点,其原因是 ______ ;
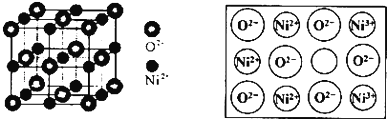
![]() 立方
立方![]() 氧化镍
氧化镍![]() 晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______
晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______ ![]() 不必计算出结果,阿伏加德罗常数的值为
不必计算出结果,阿伏加德罗常数的值为![]() 人工制备的NiO晶体中常存在缺陷
人工制备的NiO晶体中常存在缺陷![]() 如图 一个
如图 一个![]() 空缺,另有两个
空缺,另有两个![]() 被两个
被两个![]() 所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成
所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成![]() ,该晶体中
,该晶体中![]() 与
与![]() 的离子个数之比为 ______ .
的离子个数之比为 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com