
【题目】I.现有下列物质:
①HNO3②冰醋酸③氨水④Al(OH)3⑤NaHCO3(s)⑥Cu⑦氯水⑧CaCO3⑨H2CO3⑩盐酸
(1)上述物质中属于强电解质的有__________(填序号),属于弱电解质的有__________(填序号)。
(2)写出下列物质的电离方程式:④__________;⑤__________;⑨__________。
Ⅱ.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的__________(填序号)。
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸.
【答案】①⑤⑧ ②④⑨ H2O+AlO2﹣+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH﹣ NaHCO3=Na++HCO3﹣ H2CO3
Al3++3OH﹣ NaHCO3=Na++HCO3﹣ H2CO3![]() H++HCO3﹣ ③⑦⑧
H++HCO3﹣ ③⑦⑧
【解析】
I.强电解质指在水溶液或熔融状态下能够全部电离的电解质;弱电解质指水溶液或熔融状态下能够部分电离的电解质;电解质、非电解质的对象是化合物,溶液、单质既不是电解质也不是非电解质,强酸、强碱、大多数盐及活泼的金属氧化物等是强电解质;弱酸、弱碱、少数盐、水等属于弱电解质。在书写电离方程式时,强电解质的电离方程式用“=”,弱电解质电离方程式用“![]() ”。
”。
Ⅱ.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以适当升高温度,温度越高反应速率越快;可以增大氢离子的浓度,氢离子的浓度越大,反应速率越快;可以利用原电池,但是还要注意题中说的不改变氢气的量。
I.(1)①HNO3是强酸,溶于水,在水中全部电离,HNO3是强电解质;
②冰醋酸是弱酸,溶于水,在水中部分电离,冰醋酸是弱电解质;
③氨水是混合物,既不是电解质也不是非电解质;
④Al(OH)3溶于水的部分,在水溶液中部分电离,Al(OH)3是弱电解质;
⑤NaHCO3溶于水,在水中全部电离,NaHCO3是强电解质;
⑥Cu是单质,既不是电解质也不是非电解质;
⑦氯水是混合物,既不是电解质也不是非电解质;
⑧CaCO3溶于水的部分,在水中全部电离,CaCO3是强电解质;
⑨H2CO3是弱酸,在水溶液中部分电离,H2CO3是弱电解质;
⑩盐酸是混合物,既不是电解质也不是非电解质;
故上述物质属于强电解质的有①⑤⑧;上述物质属于弱电解质的有②④⑨;
(2)④Al(OH)3是两性物质并且属于弱电解质,在水溶液中既存在酸式电离,又存在碱式电离,其电离方程式为H2O+AlO2﹣+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH﹣;
Al3++3OH﹣;
⑤NaHCO3是强电解质,其电离方程式为NaHCO3=Na++HCO3﹣;
⑨H2CO3是二元弱酸,是弱电解质,分步电离,第一步电离为主,其电离方程式为H2CO3![]() H++HCO3﹣,HCO3﹣
H++HCO3﹣,HCO3﹣![]() H++CO32-;
H++CO32-;
Ⅱ.①加H2O,溶液中氢离子的物质的量浓度减小,反应速率减慢,①不符合题意;
②加NaOH固体后,OH-+H+=H2O,溶液中氢离子的浓度减小,反应速率减慢,②不符合题意;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,③符合题意;
④加CH3COONa固体生成醋酸,醋酸是弱电解质,溶液中的氢离子的浓度减小,反应速率减慢,④不符合题意;
⑤加NaCl溶液,溶液中的氢离子的浓度减小,反应速率减慢,⑤不符合题意;
⑥滴入几滴硫酸铜溶液,金属铁把溶液中的铜离子置换出来,少量的铜覆盖在铁表面,在稀盐酸中形成原电池,反应速率加快,与盐酸反应的铁的物质的量减少,导致生成氢气的物质的量减少,⑥不符合题意;
⑦升高温度(不考虑盐酸挥发),反应速率加快,⑦符合题意;
⑧改用10mL0.1mol/L盐酸,氢离子的浓度增大,反应速率加快,⑧符合题意;
故③⑦⑧符合题意。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气用于烟气的脱氮、脱硫的反应:4H2(g)+2NO(g)+SO2(g)![]() N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
A.当v(H2)=v(H2O)时,达到平衡
B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C.使用高效催化剂可提高NO的平衡转化率
D.化学平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据),根据下图回答下列问题:

(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=____________。
Ⅱ.某学生做浓度对化学反应速率的影响的实验时,将2支试管编号为①②,并按下表中物质的量进行实验,记录的时间数据是:16s、28s。请将2个数据填入下表的适当位置,并写出实验结论。
试管编号 | 加入3%Na2S2O3 | 加H2O | 加稀盐酸(1∶5) | 出现浑浊时间 |
① | 3mL | 3mL | 5滴 | a._____s |
② | 4mL | 2mL | 5滴 | b._____s |
(1)将对应①②的时间分别写出:a.____________,b.____________。
(2)实验结论____________________________________。
(3)写出反应的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
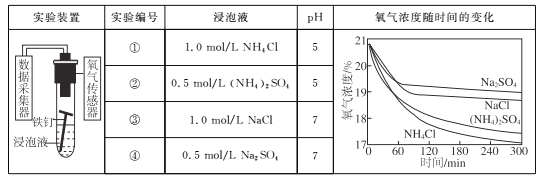
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的用途及性质的说法正确的是
A.乙烯使酸性KMnO4溶液或溴的CCl4溶液褪色的原理相同
B.苯与液溴在催化剂作用下生成溴苯发生了加成反应
C.淀粉、蛋白质等营养物质在人体内水解生成水和CO2等
D.用K2Cr2O7检验司机是否酒驾利用了乙醇的挥发性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g) ![]() CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________; a=____________kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
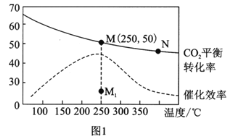
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_________。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
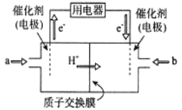
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________(填a或b),②负极电极反应式为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)只用水就能鉴别的一组物质是______
a.苯、乙酸、四氯化碳 b.乙醇、乙醛、乙酸
c.乙醛、乙二醇、硝基苯 d.苯酚、乙醇、甘油
(2)现有化合物:甲: 乙:
乙: 丙:
丙:
①请写出丙中含氧官能团的名称:____。
②请判别上述哪些化合物互为同分异构体:____(填代号)。
(3)A和B两种物质的分子式都是C7H8O芳香族化合物,它们都能跟金属Na反应放出H2;A不溶于NaOH溶液而B能溶于NaOH溶液,B能使FeCl3溶液显紫色,A不能;B苯环上的一溴代物有两种结构。则A和B的名称及结构简式为:A_____,B_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓
C.向Fe(NO3)3溶液中加入过量的HI溶液:2![]() +8H++6I-=3I2+2NO↑+4H2O
+8H++6I-=3I2+2NO↑+4H2O
D.1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl等体积混合:2![]() +5H+=Al(OH)3↓+Al3++H2O
+5H+=Al(OH)3↓+Al3++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com