
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
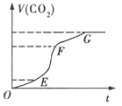
(1)实验过程如图所示,分析判断:(填“OE”、“EF”或“FG”,下同)___段化学反应速率最大,___段收集的二氧化碳气体最多。
(2)ag块状碳酸钙与足量盐酸反应,碳酸钙消耗的质量随时间的变化曲线用实线表示,在相同的条件下,将bg(a>b)粉末状碳酸钙与足量的相同浓度的盐酸反应,碳酸钙消耗的质量随时间的变化曲线用虚线表示。则图中最符合实际情况的图象是___(填序号)。
A.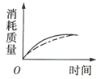 B.
B.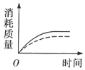 C.
C. D.
D.
(3)为了减缓题述反应的速率,下列措施中,你认为可行的是___(填序号)
A.加入蒸馏水
B.加入氯化钠固体
C.加入硝酸钾溶液
D.加入浓盐酸
E.降温
F.加入MnO2粉末
【答案】EF EF C ACE
【解析】
(1)分析题给t-V(CO2)图,OE、EF、FG三段,根据其曲线斜率以及曲线对应的CO2体积的变化值进行分析判断。
(2)增大一定量固体的表面积,可增大反应速率,据此进行分析判断。
(3)要降低反应速率,从反应速率的影响因素去考虑分析,包括:浓度、温度、催化剂、压强、接触面积等等。
(1)反应速率越大,对应曲线在图象上的斜率就越大,所以EF段化学反应速率最大;在EF段CO2体积变化也最大,即生成的CO2也最多;答案为:EF;EF;
(2)反应物的接触面积越大,反应速率越快,在相同时间内消耗碳酸钙的质量更多。又因为a大于b,盐酸足量的情况下,最终消耗碳酸钙最多的是块状碳酸钙,故刚开始反应,虚线的斜率大于实线,最终消耗的碳酸钙质量应是虚线小于实线,C项正确;答案选C;
(3)
A.加入蒸馏水,相当于稀释了盐酸,盐酸浓度降低,反应速率降低,A项正确;
B.氯化钠固体不参与反应,对反应速率没影响,B项错误;
C.硝酸钾不参与反应,加入硝酸钾溶液相当于加水稀释盐酸,盐酸浓度降低,反应速率降低,C项正确;
D.加入浓盐酸,增大了盐酸的浓度,反应速率加快,D项错误;
E.升高温度,可以加快反应速率,降低温度,反应速率降低,E项正确;
F.MnO2不参与反应,对反应速率没影响,F项错误;
故答案为:ACE。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.恒温时减小容器体积增大压强,正反应速率增大
C.830 ℃时,反应达到平衡,一定是c(CO) = c(CO2)
D.400 ℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为___。
(2)![]() 的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因_______________。
的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因_______________。
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____。
(4)Zn2+可与CN-、二苯硫腙(![]() )等形成稳定配合物。
)等形成稳定配合物。
①CN- 的结构式为_____。
②每个二苯硫腙分子中,采取sp2杂化的原子有__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
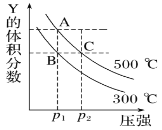
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人们在日常生活和工农业生产中应用极为广泛的一种金属。请回答下列问题:
(1)某研究性学习小组为了证明铁的金属性比铜的强,设计了如下几种方案,其中合理的有___(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片上无气泡产生
E.常温下,将铁片和铜片分别置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属性比铜的强的实验。要求:该实验方案的原理不同于(1)中任何一个方案。
①画出实验装置图并注明所需药品___。
②写出实验过程中的主要现象:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气用于烟气的脱氮、脱硫的反应:4H2(g)+2NO(g)+SO2(g)![]() N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
A.当v(H2)=v(H2O)时,达到平衡
B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C.使用高效催化剂可提高NO的平衡转化率
D.化学平衡常数表达式为K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com