
����Ŀ����֪��Ӧ![]() ��Ϊ�о�Ӱ��÷�Ӧ���ʵ����أ��ڲ�ͬ�����½���4��ʵ�飬Y��Z����ʼŨ��Ϊ0����Ӧ��X��Ũ���淴Ӧʱ��ı仯�����ͼ��ʾ������˵������ȷ����( )
��Ϊ�о�Ӱ��÷�Ӧ���ʵ����أ��ڲ�ͬ�����½���4��ʵ�飬Y��Z����ʼŨ��Ϊ0����Ӧ��X��Ũ���淴Ӧʱ��ı仯�����ͼ��ʾ������˵������ȷ����( )
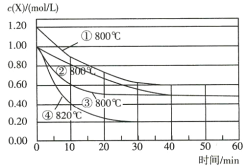
A.��ʵ��ڡ���ֻ�ı�һ������������ʵ��ڡ��ܵó����ۣ������¶ȣ���ѧ��Ӧ���ʼӿ�
B.��ʵ��١���ֻ�ı�һ������������ʵ��١��ڵó����ۣ�����Ӧ��Ũ�ȣ���ѧ��Ӧ���ʼӿ�
C.��ʵ��ڡ���ֻ�ı�һ����������ʵ���ʹ���˴���
D.0��10min�ڣ�ʵ��۵�ƽ������v(Y)=0.04 mol/(L��min)
���𰸡�D
��������
A����ʵ��ڡ���ֻ�ı�һ��������ʵ��ڡ�������ʵ�飬X����ʼŨ����ͬ���¶��ɵڢ���ʵ���800�����ߵ�820�棬��Ӧ�������Լӿ죬˵���¶����ߣ���ѧ��Ӧ���ʼӿ죬Aѡ����ȷ��
B����ͼ���п��Կ�����ʵ��١�������ʵ�飬�¶���ͬ�����ŷ�ӦΪX��Ũ������ѧ��Ӧ���ʼӿ죬Bѡ����ȷ��
C��ʵ��ڡ�������ʵ�飬X����ʼŨ����ȣ��¶���ͬ��ƽ��״̬Ҳ��ͬ����ʵ��۴ﵽƽ���ʱ��̣���Ӧ���ʿ죬˵��ʵ���ʹ���˴�����Cѡ����ȷ��
D����0��10min�ڣ�ʵ��۵�ƽ������v(X)=��1.0mol/L��0.6mol/L����10min��0.04mol/(L��min)����Ϊ��ѧ��Ӧ����֮�ȵ��뻯ѧ������֮�ȣ�����v(Y)=0.02mol/(L��min)����D�����
��ѡD��


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�ý����������ʵ�̽��ʵ�顣����˵���������ǣ� ��
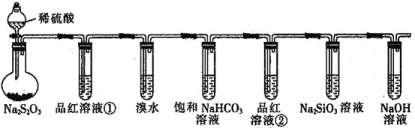
A.��Ʒ����Һ����ɫ����˵�������к���SO2
B.����ˮ��ɫ����˵��SO2���л�ԭ��
C.����ƿ�г��ֵ���ɫ���Ǻ���ɫ���ݣ���˵��Na2S2O3ֻ��������
D.��Ʒ����Һ�ڲ���ɫ��Na2SiO3��Һ���ְ�ɫ���ǣ���˵���������̼������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ����ͬʱ��SO2��CO2���Ϊ����װ����ͼ��ʾ(�缫��Ϊ���Ե缫)������˵������ȷ����

A. aΪ����������������Ӧ
B. װ�ù���ʱ�����Ӵ�c������b��
C. ��b������16gO2����Y�������Һ��������16g
D. d�缫��ӦʽΪCO2+6H++6e��=CH3OH+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() ˮ���˵���������( )
ˮ���˵���������( )
A.��ϡ��Һ�У�ˮ��ﵽƽ��ʱ�����ۼ�![]() ������Һ���Ǽ�ˮϡ�ͣ�ƽ��������ƶ�
������Һ���Ǽ�ˮϡ�ͣ�ƽ��������ƶ�
B.Ũ��Ϊ![]() ��
��![]() ������
������![]() ��Һ������������ͬʱ��
��Һ������������ͬʱ��![]() ��ˮ��̶�ǰ��С�ں���
��ˮ��̶�ǰ��С�ں���
C.����������ͬʱ��ͬŨ�ȵ�![]() ��Һ��50 ���20 ��ʱ����ˮ�⣬50 ��ʱ
��Һ��50 ���20 ��ʱ����ˮ�⣬50 ��ʱ![]() ��ˮ��̶ȱ�20 ��ʱ��С
��ˮ��̶ȱ�20 ��ʱ��С
D.Ϊ����![]() ��ˮ�⣬���õر���
��ˮ�⣬���õر���![]() ��Һ��Ӧ����������
��Һ��Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ı�0.1 mol��L��1��Ԫ����H2A��Һ��pH����Һ�е�H2A��HA����A2�������ʵ���������(X)��pH�ı仯��ͼ��ʾ[��֪![]() ]��������������ȷ����( )
]��������������ȷ����( )

A.NaHA��Һ�У�HA����ˮ������С��HA���ĵ�������
B.lg[K2(H2A)]����4.2
C.�������ʵ�����NaHA��Na2A���������ˮ�����õ���Һ�Ц�(HA��)����(A2��)
D.0.1 mol��L1 NaHA��Һ�У�c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol��L1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
(1)��̬Siԭ���У�����ռ�ݵ�����ܲ����Ϊ___�����ܲ���е�ԭ�ӹ����Ϊ___��
(2)BF3��һ������ˮ�γ�(H2O)2BF3����Q��Q��һ�������¿�ת��ΪR��

����Q����������������____(�����)��
a ���Ӽ� b ���ۼ� c ��λ�� d ���
(3)��һ������I1(Zn)___I1(Cu)(��������������С����)��ԭ����______��
(4)ʯīϩ(��ͼa)��һ���ɵ���̼ԭ�ӹ��ɵ�ƽ��ṹ����̼���ϣ�ʯīϩ�в���̼ԭ�ӱ���������ƽ��ṹ�ᷢ���ı䣬ת��Ϊ����ʯīϩ(��ͼb)��
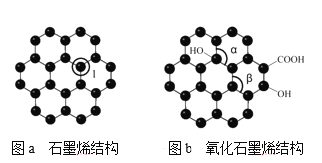
ͼa�У�1��C������C�γ������ĸ���Ϊ____��ͼb�м�����___��������(����>������<���������� )��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����𡢵����ס�ͭ��п�Ļ�������������Ҫ��;���ش��������⣺
(1)��̬Bԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____����̬Cu+�ĺ�������Ų�ʽΪ___��
(2)![]() �Ŀռ乹����________��HNO3�����Ա�HNO2ǿ���Դӽṹ�ĽǶȽ�����ԭ��_______________��
�Ŀռ乹����________��HNO3�����Ա�HNO2ǿ���Դӽṹ�ĽǶȽ�����ԭ��_______________��
(3)������(H3PO3)����Ԫ�ص�һ�ֺ����ᣬ��NaOH��Ӧֻ����NaH2PO3��Na2HPO3�����Σ���H3PO3���ӵĽṹʽΪ____��
(4)Zn2+����CN������������(![]() )���γ��ȶ�����
)���γ��ȶ�����
��CN�� �ĽṹʽΪ_____��
��ÿ��������������У���ȡsp2�ӻ���ԭ����__����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������������ճ������м�Ϊ�������ᣬ��һ�������£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO+H+ ��H��0��
CH3COO+H+ ��H��0��
��1�����³�ѹ�£���pH=5��ϡ������Һ�У�c(CH3COO��=__������ȷֵ�����з����У�����ʹ0.10mol��L��1CH3COOH�ĵ���̶��������___��
a.��������0.10mol��L1��ϡ���� b.����CH3COOH��Һ c.�������������� d.��ˮϡ����0.010mol��L��1 e.���������Ȼ��ƹ��� f.��������0.10mol��L��1��NaOH��Һ
��2����֪��90��ʱ��ˮ�����ӻ�����ΪKw=38��10��14���ڴ��¶��£���pH=3�������pH=11������������Һ�������ϣ�������Һ�е�c(H+)=___��������λ��Ч���֣���
��3������Ũ�Ⱦ�Ϊ0.1mol/L��������Һ�������� �ڴ��� ���������� ���Ȼ�� �ݴ���� ������� ��������� �ఱˮ����ش��������⣺
��.�١��ڡ��ۡ���������Һ����ˮ�������H����Ũ���ɴ�С��˳����(�����)__��
��.�ܡ��ݡ��ޡ��ߡ���������Һ��NH4+Ũ���ɴ�С��˳����(�����)___��
��4��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣ���������£���a mol/L��CH3COOH��b mol/LBa��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO-�����ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���й���������ȷ���ǣ� ��
��� | �� | �� | �� | �� |
pH | 10 | 10 | 4 | 4 |
��Һ | ��ˮ | ����������Һ | ������Һ | ���� |
A.��ͬ����ۡ�����Һ�ֱ���NaOH��ȫ��Ӧ������NaOH���ʵ������ۣ���
B.�ֱ��ˮϡ��10����������Һ��pH���٣��ڣ��ܣ���
C.�١�������Һ�������ϣ�������ҺΪ����
D.VaL����Һ��VbL����Һ��ϣ�������Ϊ�����Һ�����Va��Vb��������Ϻ���ҺpH��5����Va�UVb��9�U11
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com