
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
实验内容 | 实验目的 | |
A | 向某未知溶液中加入 | 检验是否含 |
B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含 |
C | 加热分别用 | 探究 |
D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
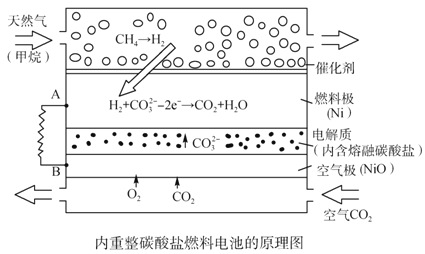
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是

A. 试管内壁上的“黄霜”的成分是硫
B. 该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C. 烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D. 试管中浓硝酸可以用浓盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。在该温度下,向足量的饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置。试求最终所得晶体的质量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相关知识回答下列问题
(1)①已知H2与O2反应生成lmolH2O(g)时放出241.8kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)-2H2O(g)△H=_____________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s)△H>0 则稳定性:石墨_________金刚石(填“>”、“<“或“=”)。
(2)①25℃时,0.10mol/L的NaHCO3溶液呈碱性,原因是_________水解引起的(填“Na+”或“HCO3-”);该溶液中c(Na+)+c(HCO3-)_________0.2mol/L(填“>”、“<“或 “=”)
②常温下,0.0100mol/L盐酸的pH=________________;
③用0.0100mol/L盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为__________(填“蓝色“或“无色”),且半分钟内保持不变。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0, 平衡常数表达式为K=
Fe(s)+CO2(g)△H>0, 平衡常数表达式为K=![]()
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K____________(填“增大”、“减少”“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025mol/L,c(CO)=0.10mol/L,此时刻反应_____________平衡状态(填“达到”或“未达到”);其理由为:__________(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏得到
B.C6H3Cl2Br的同分异构体有7种(不含立体异构)
C.乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
D.X是苯的同系物,苯环上有两个位于对位的取代基,其结构可表示为![]() ,则X的结构共有(不考虑立体异构)10种
,则X的结构共有(不考虑立体异构)10种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com