
【题目】已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。在该温度下,向足量的饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置。试求最终所得晶体的质量_____。
科目:高中化学 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)="0.100" mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B. c(Na+)="0.100" mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)>2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
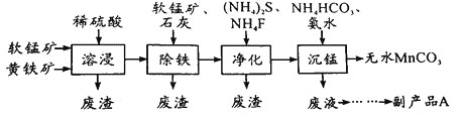
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
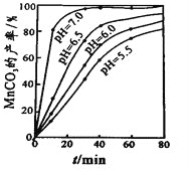
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
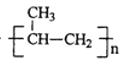
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。
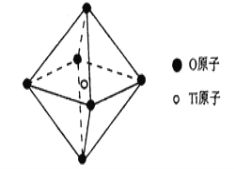
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可丁是一种药物,该药物适用于刺激性干咳病人服用,无成瘾性,化合物H是制备该药物的重要中间体,合成路线如下:
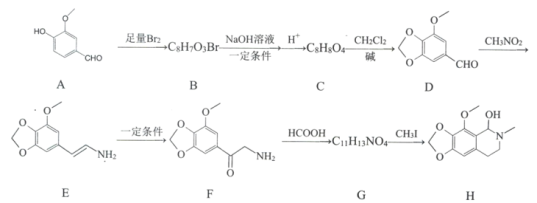
已知:①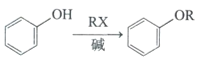
②RNH2 ![]() RNHCH3
RNHCH3
(1)化合物B的结构简式:________。
(2)反应B→C的第一步反应类型:____________。
(3)下列说法正确的是:___________。
A 物质D能与FeCl3发生显色反应 B 物质F具有碱性
C 物质G能和银氨溶液发生反应 D 物质H的分子式是C12H15NO4
(4)写出C→D的化学方程式:____________。
(5)请写出化合物H满足下列条件的所有同分异构体的结枸简式:_______________。
①分子中含苯环,无其他环状结构
②分子中含有NO2且直接连在苯环上
③分子中只有3种不同化学环境的氢
(6)已知CH2=CHCH3![]() CH2CHCH2Cl,请以
CH2CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() ,写出制备的合成路线流程图(无机试剂任选)______________。
,写出制备的合成路线流程图(无机试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,![]()
![]() ,
,![]() ,某二元酸
,某二元酸![]() 及其钠盐的溶液中,
及其钠盐的溶液中,![]() 、
、![]() 、
、![]() 分别在三者所占的物质的量分数
分别在三者所占的物质的量分数![]() 随溶液pH变化关系如图所示,下列叙述错误的是
随溶液pH变化关系如图所示,下列叙述错误的是

A.在![]() 的溶液中:
的溶液中:![]()
B.等体积等浓度的NaOH溶液与![]() 溶液混合后,溶液中水的电离程度比纯水小
溶液混合后,溶液中水的电离程度比纯水小
C.在![]() 的溶液中存在
的溶液中存在
D.向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000![]() NaOH溶液滴定20.00mL某未知浓度的CH3COOH溶液,滴定曲线如右图所示。已知在点③处恰好中和。下列说法不正确的是( )
NaOH溶液滴定20.00mL某未知浓度的CH3COOH溶液,滴定曲线如右图所示。已知在点③处恰好中和。下列说法不正确的是( )
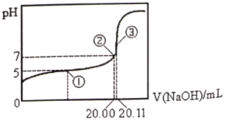
A. 点①②③三处溶液中水的电离程度依次增大
B. 该温度时CH3COOH的电离平衡常数约为![]()
C. 点①③处溶液中均有c(H+)=c(CH3COOH)+c(OH-)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com