
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
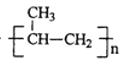
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。
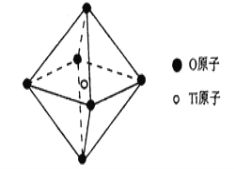
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
【答案】[Ar] 3d1 sp2 sp3 Cl>Mg>Al ![]() 18NA SrTiO3
18NA SrTiO3
【解析】
(1)Ti是22号元素,电子排布式为[Ar]3d24s2,Ti3+的基态核外电子排布式为[Ar]3d1。
(2)丙烯分子中,第2、3个碳原子有三个价键即为sp2杂化,第1个碳原子有四个价键即为sp3杂化。
(3)铜周期电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIIA族,因此Mg、Al、Cl第一电离能由大到小的顺序是Cl>Mg>Al。
(4)根据N = O或C2 = O,与CO互为等电子体的阴离子为CN或C22,再写其电子式。
(5)一个水有2个 σ键,1mol[Ti(H2O)6]Cl3中含有σ键的数目为(2×6 + 6)NA =18NA。
(6)该晶体的晶胞中Sr位于晶胞的顶点即![]() 个,O位于晶胞的面心即
个,O位于晶胞的面心即![]() 个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3。
个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3。
(1)Ti是22号元素,电子排布式为[Ar]3d24s2,Ti3+的基态核外电子排布式为[Ar]3d1,故答案为:[Ar]3d1。
(2)丙烯分子中,第2、3个碳原子有三个价键即为sp2杂化,第1个碳原子有四个价键即为sp3杂化,故答案为:sp2;sp3。
(3)铜周期电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIIA族,因此Mg、Al、Cl第一电离能由大到小的顺序是Cl>Mg>Al,故答案为:Cl > Mg > Al。
(4)根据N = O或C2 = O,与CO互为等电子体的阴离子为CN或C22,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(5)一个水有2个 σ键,1mol[Ti(H2O)6]Cl3中含有σ键的数目为(2×6 + 6)NA =18NA,故答案为:18NA。
(6)该晶体的晶胞中Sr位于晶胞的顶点即![]() 个,O位于晶胞的面心即
个,O位于晶胞的面心即![]() 个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3,故答案为:SrTiO3。
个,Ti原子填充在O原子构成的正八面体空隙的中心位置即1个,因此钛酸锶的化学式为SrTiO3,故答案为:SrTiO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。在该温度下,向足量的饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置。试求最终所得晶体的质量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
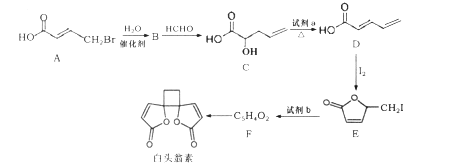
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
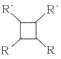
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成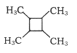 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备.储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知: H2(g)+A(l)=B(l)ΔH1 O2(g)+B(l)=A(l)+H2O2(l)ΔH2 ,其中A.B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH________0(填“>”.“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收ymol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向血红色的Fe(SCN)3溶液中加入少量KI 固体,溶液颜色变浅
B.氨水溶液加水稀释,c(OH-)增大,平衡常数增大
C.pH=12的NaOH和Na2S溶液中水的电离程度前者大于后者
D.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com