
【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表达正确的是( )
A. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
B. 邻硝基甲苯的结构简式为![]() ,能发生取代反应
,能发生取代反应
C. 钾长石(KAlSi3O8)写成氧化物形式为:K2OAl2O36SiO2
D. 反应的电子转移情况: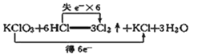
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L Cr2O72-含量为108mgL-1的含铬废水,至少需要______L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),需调节溶液pH______。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考察反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000molL-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述②溶液中再滴加![]() 溶液,产生白色沉淀;④
溶液,产生白色沉淀;④![]() 取③中上层清液继续滴加
取③中上层清液继续滴加![]() 溶液至无沉淀时,再滴加
溶液至无沉淀时,再滴加![]() 溶液,产生白色沉淀。根据实验以下推测正确的是
溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有![]() 离子B.不一定有
离子B.不一定有![]() 离子
离子
C.不能确定![]() 离子是否存在D.不能确定
离子是否存在D.不能确定![]() 离子是否存在
离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2L的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
t(℃) | 750 | 850 | 1000 |
CO% | 0.7 | 2/3 | 0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:
C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_________________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
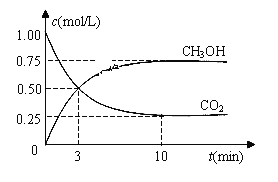
①从反应开始到平衡,氢气的平均反应速率v(H2)=_________
②若改变条件使平衡向正反应方向移动,则平衡常数_________
a.不变 b.减小 c.增大 d.不变或减小 e.不变或增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来食品安全问题成为社会各界日益关注的焦点话题.香港地区食环署食物安全中心曾对十五个桂花鱼样本进行化验,结果发现十一个样本中含有孔雀石绿。孔雀石绿是化工产品,具有较高毒性,高残留,且长期服用后,容易致癌、致畸,对人体有害。其结构简式如图所示。下列关于孔雀石绿的说法正确的是( )
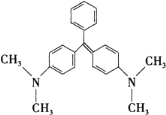
A.孔雀石绿的分子式为C23H25N2
B.1mol孔雀石绿在一定条件下最多可与6molH2发生加成反应
C.孔雀石绿属于芳香烃
D.孔雀石绿苯环上的一氯取代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
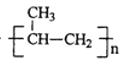
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。
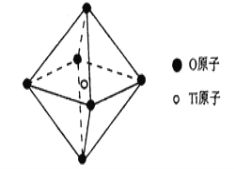
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com