
【题目】近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2L的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
t(℃) | 750 | 850 | 1000 |
CO% | 0.7 | 2/3 | 0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:
C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_________________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
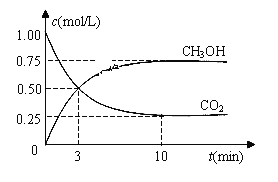
①从反应开始到平衡,氢气的平均反应速率v(H2)=_________
②若改变条件使平衡向正反应方向移动,则平衡常数_________
a.不变 b.减小 c.增大 d.不变或减小 e.不变或增大
【答案】![]() 向右进行 CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol 0.225mol·L-1·min-1 e
向右进行 CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol 0.225mol·L-1·min-1 e
【解析】
(1)利用三段式,分别计算1000℃、850℃时的平衡常数,根据Q与K的关系判断反应方向;
(2) 根据盖斯定律计算CO和H2O生成CO2和H2的焓变;
(3) ① 根据![]() 计算v(H2);
计算v(H2);
②根据影响平衡常数的因素分析;
(1) 1000℃时,CO平衡转化率为0.5
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始 1 2 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 1.5 0.5 0.5
1000℃时,![]()
![]() ;
;
850℃时,CO平衡转化率为![]()
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始1 2 0 0
转化![]()
![]()
![]()
![]()
平衡 ![]()
![]()
![]()
![]()
850℃时, 1;850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,
1;850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,![]() =
=![]() ,Q<K,反应向右进行;
,Q<K,反应向右进行;
(2) ①C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
②2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol1
③C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
根据盖斯定律 ①-②-③得CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol;
(3) ① 根据图像,甲醇的浓度变化量为0.75mol/L,则氢气的浓度变化量为0.75mol/L×3=2.25 mol/L, ![]() 0.225mol·L-1·min-1;
0.225mol·L-1·min-1;
②平衡常数只与温度有关,若改变温度平衡正向移动,则平衡常数增大,若改变其它因素平衡正向移动,则平衡常数不变,故选e;


科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
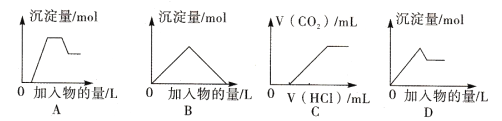
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个相同的容器中,在不同的温度下(其它条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是( )
A.v(NH3)=0.1 mol /(Lmin)B.v(H2)=0.6 mol /(Lmin)
C.v(N2)=0.005 mol /(Ls)D.v(H2)=0.3 mol /(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向右移动,c(H+)减小
B.加入少量CH3COONa固体,平衡向右移动
C.加入水时,平衡向右移动,CH3COOH电离常数增大
D.加入少量pH=5的硫酸,溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含![]() 的溶液中,可能还存在
的溶液中,可能还存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子中的一种或几种.进行以下实验
六种离子中的一种或几种.进行以下实验
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入![]() 溶液时,无沉淀生成;
溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①蛋白质 ②油脂 ③葡萄糖 ④纤维素⑤淀粉五种物质中,不能水解的是______(填序号),在人体中不能直接被消化吸收的是________(填序号),蛋白质水解后最终生成__________(填名称),油脂水解后得到醇的结构简式是_________。
(2)某学生设计用如下实验方案用以检验淀粉水解的情况:

由水解液分别进行上述实验后的现象,可得出的实验结论应该是________(填序号)。
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
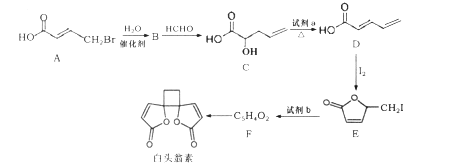
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
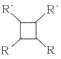
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成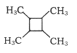 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com