
【题目】已知:常温下,![]()
![]() ,
,![]() ,某二元酸
,某二元酸![]() 及其钠盐的溶液中,
及其钠盐的溶液中,![]() 、
、![]() 、
、![]() 分别在三者所占的物质的量分数
分别在三者所占的物质的量分数![]() 随溶液pH变化关系如图所示,下列叙述错误的是
随溶液pH变化关系如图所示,下列叙述错误的是

A.在![]() 的溶液中:
的溶液中:![]()
B.等体积等浓度的NaOH溶液与![]() 溶液混合后,溶液中水的电离程度比纯水小
溶液混合后,溶液中水的电离程度比纯水小
C.在![]() 的溶液中存在
的溶液中存在
D.向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]()
【答案】D
【解析】
据图可知,在二元酸H2A及其钠盐的溶液中,随着pH的增大,H2A的物质的量分数逐渐减小,HA-的物质的量分数先增大后减小,A2-的物质的量分数逐渐增大。pH=1.3时, c(H2A)=c(HA-),![]()
![]() =c(H+)=10-1.3;pH=4.4时,c(HA-)=c(A2-),
=c(H+)=10-1.3;pH=4.4时,c(HA-)=c(A2-),![]() =c(H+)=10-4.4;Ka1
=c(H+)=10-4.4;Ka1![]() Ka2>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
Ka2>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
![]() 在
在![]() 的溶液中,
的溶液中,![]() ,溶液中电荷守恒为:
,溶液中电荷守恒为:![]() ,所以
,所以![]() ,故A正确;
,故A正确;
B. 等体积等浓度的NaOH溶液与![]() 溶液混合后,生成NaHR,溶液显酸性,HA-电离>水解,水的电离受到抑制,所以溶液中水的电离程度比纯水小,故B正确;
溶液混合后,生成NaHR,溶液显酸性,HA-电离>水解,水的电离受到抑制,所以溶液中水的电离程度比纯水小,故B正确;
C. 当溶液![]() 时,
时,![]() ,则
,则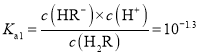 ,溶液的
,溶液的![]() 时,
时,![]() ,则
,则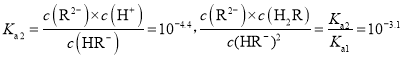 ,故C正确;
,故C正确;
D. 由C选项分析可知,![]() 的电离常数
的电离常数![]() 大于
大于![]() 的
的![]() ,即酸性:
,即酸性:![]() ,所以向
,所以向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]() ,故D错误;
,故D错误;
答案选D


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
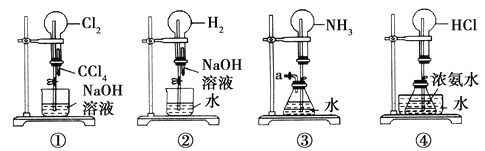
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。在该温度下,向足量的饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置。试求最终所得晶体的质量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备.储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知: H2(g)+A(l)=B(l)ΔH1 O2(g)+B(l)=A(l)+H2O2(l)ΔH2 ,其中A.B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH________0(填“>”.“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收ymol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相关知识回答下列问题
(1)①已知H2与O2反应生成lmolH2O(g)时放出241.8kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)-2H2O(g)△H=_____________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s)△H>0 则稳定性:石墨_________金刚石(填“>”、“<“或“=”)。
(2)①25℃时,0.10mol/L的NaHCO3溶液呈碱性,原因是_________水解引起的(填“Na+”或“HCO3-”);该溶液中c(Na+)+c(HCO3-)_________0.2mol/L(填“>”、“<“或 “=”)
②常温下,0.0100mol/L盐酸的pH=________________;
③用0.0100mol/L盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为__________(填“蓝色“或“无色”),且半分钟内保持不变。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0, 平衡常数表达式为K=
Fe(s)+CO2(g)△H>0, 平衡常数表达式为K=![]()
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K____________(填“增大”、“减少”“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025mol/L,c(CO)=0.10mol/L,此时刻反应_____________平衡状态(填“达到”或“未达到”);其理由为:__________(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向血红色的Fe(SCN)3溶液中加入少量KI 固体,溶液颜色变浅
B.氨水溶液加水稀释,c(OH-)增大,平衡常数增大
C.pH=12的NaOH和Na2S溶液中水的电离程度前者大于后者
D.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如下图。下列关于分枝酸的叙述正确的是( )
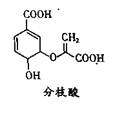
A.分子中含有3种官能团
B.1mol分枝酸最多可与3mol NaOH发生中和反应
C.可与乙醇、乙酸反应,且反应类型相同
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. CaCO3的电离方程式:CaCO3 ![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,判断下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的有几个( )
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,判断下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的有几个( )
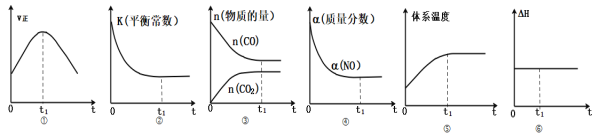
A.2个B.3个C.4个D.5个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com