
【题目】在一定条件下NO2与SO2气体发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1molNO2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________( ![]() )。
)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
(4)若同pH同体积的下列溶液:①醋酸溶液;②盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _______________(填序号)。
Ⅱ.重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0,ρ=1 g/mL)中含有
Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S |
Ksp | 8.3×1012 | 5.6×108 | 6.3×1050 |
难溶电解质 | PbI2 | Pb(OH)2 | PbS |
Ksp | 7.1×109 | 1.2×1015 | 3.4×1028 |
(1)你认为往废水中加入________(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____。
(3)如果用食盐处理只含Ag+的废水,测得处理后的废水(ρ=1 g/mL)中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1×108mol/L,问该工厂处理后的废水中Ag+是否符合排放标准? _______已知Ksp(AgCl)=1.8×1010。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的说法正确的是 ( )
A.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
B.已知C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.当H为“-”时,表示该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式(或离子方程式)说明:
盐碱地产生碱性的原因:______________________________;
(2)请用离子方程式表示明矾净水的原理:_______________________
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n(填“>”“<”或“=”)。
(4)25℃时,将amol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”)。
(5)如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是_____________。
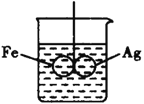
A.铁圈和银圈左右摇摆不定 B.铁圈和银圈保持平衡状态
C.铁圈向下倾斜,银圈向上倾斜 D.银圈向下倾斜,铁圈向上倾斜
写出银圈上的电极反应式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.保持容器容积不变,向其中加入![]() ,反应速率一定加快
,反应速率一定加快
B.保持容器容积不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入![]() 和
和![]() ,反应速率一定加快
,反应速率一定加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为2∶1的是 ( )
A.在反应2FeCl3+Fe =3FeCl2中还原产物与氧化产物的质量
B.相同温度下,0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s) = C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2SO2(g)+O2(g) ![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
C.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D.已知2C(s)+2O2(g) = 2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
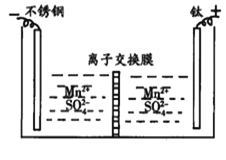
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )
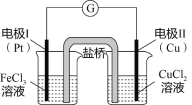
A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com