
【题目】I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________( ![]() )。
)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
(4)若同pH同体积的下列溶液:①醋酸溶液;②盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _______________(填序号)。
Ⅱ.重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0,ρ=1 g/mL)中含有
Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S |
Ksp | 8.3×1012 | 5.6×108 | 6.3×1050 |
难溶电解质 | PbI2 | Pb(OH)2 | PbS |
Ksp | 7.1×109 | 1.2×1015 | 3.4×1028 |
(1)你认为往废水中加入________(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____。
(3)如果用食盐处理只含Ag+的废水,测得处理后的废水(ρ=1 g/mL)中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1×108mol/L,问该工厂处理后的废水中Ag+是否符合排放标准? _______已知Ksp(AgCl)=1.8×1010。
【答案】1 1% > 9.9×10-7 醋酸 B 1.2×103 mol/L 符合排放标准
【解析】
I.(1)浓度的盐酸和醋酸溶液,开始时盐酸中氢离子浓度大,pH小,因此得到滴定盐酸的曲线。
(2)开始时盐酸pH=1,说明盐酸浓度为0.1mol/L,滴定前醋酸pH = 3,则电离出的氢离子浓度为0.001mol/L,即可算滴定前CH3COOH的电离度。
(3)如果都消耗20mL,则1图中刚好处于中性,2图中生成醋酸钠显碱性,因此达到B、D状态时,反应消耗的NaOH溶液的体积a > b;若图中E点pH=8,则c(Na+) c(CH3COO) = c(OH) c(H+) = 1×106 mol/L 1×108 mol/L=9.9×107 mol/L。
(4)同pH同体积的醋酸溶液与盐酸溶液,醋酸浓度远远大于盐酸浓度,体积相等,醋酸的物质的量大于盐酸的物质的量,因此所需氢氧化钠物质的量较大的是醋酸。
Ⅱ.(1)根据Ksp的大小关系计算,AgI、AgOH、Ag2S三者中c(Ag+)最小的是Ag2S,PbI2、Pb(OH)2、PbS三者中c(Ag+)最小的是PbS,因此往废水中加入Na2S。
(2)用生石灰处理上述废水,使溶液的pH=8,c(OH) =1×106 mol/L,再计算铅离子浓度。
(3)先计算氯化钠溶液的物质的量浓度,再根据Ksp计算环境中c(Ag+),继而得到结论。
I.(1)等浓度的盐酸和醋酸溶液,开始时盐酸中氢离子浓度大,pH小,因此滴定盐酸的曲线是图1,故答案为:1。
(2)开始时盐酸pH=1,说明盐酸浓度为0.1mol/L,滴定前醋酸pH = 3,则电离出的氢离子浓度为0.001mol/L,因此滴定前CH3COOH的电离度为![]() ,故答案为:1%。
,故答案为:1%。
(3)如果都消耗20mL,则1图中刚好处于中性,2图中生成醋酸钠显碱性,因此达到B、D状态时,反应消耗的NaOH溶液的体积a > b;若图中E点pH=8,则c(Na+) c(CH3COO) = c(OH) c(H+) = 1×106 mol/L 1×108 mol/L=9.9×107 mol/L,故答案为:>;9.9×107。
(4)同pH同体积的醋酸溶液与盐酸溶液,醋酸浓度远远大于盐酸浓度,体积相等,醋酸的物质的量大于盐酸的物质的量,因此所需氢氧化钠物质的量较大的是醋酸,故答案为:①。
Ⅱ.(1)根据Ksp的大小关系计算,AgI、AgOH、Ag2S三者中c(Ag+)最小的是Ag2S,PbI2、Pb(OH)2、PbS三者中c(Pb2+)最小的是PbS,因此往废水中加入Na2S,故答案为:B。
(2)用生石灰处理上述废水,使溶液的pH=8,c(OH) = 1×106 mol/L,处理后废水中![]() ,故答案为:1.2×103 mol/L。
,故答案为:1.2×103 mol/L。
(3)如果用食盐处理只含Ag+的废水,测得处理后的废水(ρ=1 g/mL)中NaCl的质量分数为0.117%,![]() ,若环境要求排放标准为c(Ag+)低于1×108mol/L,
,若环境要求排放标准为c(Ag+)低于1×108mol/L,![]() ,c(Ag+)低于1×108mol/L,符合排放标准,故答案为:符合排放标准。
,c(Ag+)低于1×108mol/L,符合排放标准,故答案为:符合排放标准。


科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
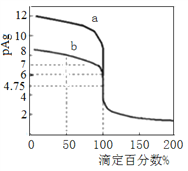
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
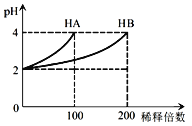
A.HA的电离方程式为HA![]() H++A-
H++A-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.0.1mol/L NaB溶液中: c(H+)= c(OH-)+c(HB)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如图所示。下列说法不正确的是
时,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如图所示。下列说法不正确的是

A.![]()
B.![]() 点时两溶液中水的电离程度相同
点时两溶液中水的电离程度相同
C.曲线![]() 表示
表示 与pH的变化关系
与pH的变化关系
D.![]() 溶液中存在:
溶液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃( )因具有良好的性能而广泛应用于生产生活中。下图所示流程可用于合成有机玻璃,请回答下列问题:
)因具有良好的性能而广泛应用于生产生活中。下图所示流程可用于合成有机玻璃,请回答下列问题:

(1)A的名称为_______________;
(2)B→C的反应条件为_______________;D→E的反应类型为_______________;
(3)两个D分子间脱水生成六元环酯,该酯的结构简式为______________;
(4)写出下列化学方程式:
G→H:_______________________________;
F→有机玻璃:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母编号,可多选)。

(2)下图是某市污水处理的工艺流程示意图:

①下列物质中不可以作为混凝剂(沉降剂)使用的是______(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母编号)。
A.物理变化 B.化学变化
C既有物理变化又有化学变化
(3)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2===KOCN+2KCl+H2O再投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:
___KOCN+___KOH+___Cl2―→___CO2+___N2+___KCl+___H2O。若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2HBr(g)![]() Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.63 | 0.60 | 0.60 | 0.60 | |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是( )
A.从上表数据分析,2HBr(g)![]() Br2(g)+H2(g)正反应为放热反应
Br2(g)+H2(g)正反应为放热反应
B.实验2中HBr的初始浓度C2=1.0 mol/L
C.实验3反应速率小于实验1的反应速率
D.实验4一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下NO2与SO2气体发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1
将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明该反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1molNO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com