
����Ŀ����Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣺
(1)�μ��(���϶�Na2CO3��NaCl)������ֲ�����������û�ѧ����ʽ(�����ӷ���ʽ)˵����
�μ�ز������Ե�ԭ��______________________________��
(2)�������ӷ���ʽ��ʾ������ˮ��ԭ����_______________________
(3)��ȡpH���������ȵ�NaOH��Һ�Ͱ�ˮ�ֱ���ˮϡ��m����n����ϡ�ͺ�pH����ȣ���m________n(����>����<������=��)��
(4)25��ʱ����amol��L��1��ˮ��0.01mol��L��1����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��________��(����������������������)��
(5)��ͼ��ʾ������Ȧ����Ȧ�ĺ��Ӵ�����һ�����߽�������ʢˮ���ձ��У�ʹ֮ƽ�⣻С�����ձ��������CuSO4��Һ��Ƭ�̺�ɹ۲쵽��������_____________��
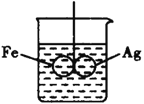
A.��Ȧ����Ȧ����ҡ�ڲ��� B.��Ȧ����Ȧ����ƽ��״̬
C.��Ȧ������б����Ȧ������б D.��Ȧ������б����Ȧ������б
д����Ȧ�ϵĵ缫��Ӧʽ��__________________��
���𰸡�CO32-+H2O![]() HCO3-+OH- Al3++3H2O
HCO3-+OH- Al3++3H2O![]() Al(OH)3+3H+ < �� D Cu2++2e-=Cu
Al(OH)3+3H+ < �� D Cu2++2e-=Cu
��������
(1)�����ε�ˮ����ɷ�����
(2)������ǿ�������Σ�����Һ��������ˮ������������������������ˮ���ã�
(3)һˮ�ϰ���������ʣ���ˮϡ�ʹٽ�һˮ�ϰ����룻
(4)���ݵ���غ������
(5)��Ȧ����Ȧ���ӽ�������ͭ��Һ�У���װ�ù�����ԭ��أ��ϻ��õĽ������������ϲ����õĽ����������������������Ϸ����ĵ缫��Ӧ�жϷ�Ӧ����
(1)̼������ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ�ˮ�ⷴӦ�ķ���ʽΪˮ�ⷽ��ʽΪCO32-+H2O![]() HCO3-+OH-��
HCO3-+OH-��
(2)������ǿ�������Σ�����Һ��Al3+����ˮ�����ã�Al3++3H2O![]() Al(OH)3(����)+3H+��ˮ�������������������������������ǿ���ܹ�����ˮ�������Ĺ������ʣ�ʹ֮�γɳ�����ʹˮ��������˿�����ˮ���ã�
Al(OH)3(����)+3H+��ˮ�������������������������������ǿ���ܹ�����ˮ�������Ĺ������ʣ�ʹ֮�γɳ�����ʹˮ��������˿�����ˮ���ã�
(3)һˮ�ϰ���������ʣ���ˮϡ�ʹٽ�һˮ�ϰ����룬NaOH��ǿ����ʣ���ȫ���룬ҪʹpH��ȵİ�ˮ��NaOH��Һϡ�ͺ�pH��Ȼ��ȣ���ˮϡ�ͱ�������NaOH����m<n��
(4)25��ʱ����amol��L-1��ˮ��0.01mol��L-1����������ϣ����߷�����Ӧ����Ӧ����Һ�к���H+��NH4+��OH-��Cl-����Һ�д��ڵ����غ㣺c(NH4+)+c(H+)=c(OH-)+c(Cl-)�����ڷ�Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��c(H+)=c(OH-)��������Һ�����ԣ�
(5)��Ȧ����Ȧ���ӽ�������ͭ��Һ�У���װ�ù�����ԭ��أ��ϻ��õĽ���Fe���������ϲ����õĽ���Ag����������������ʧ���������������ӽ�����Һ���缫��ӦʽΪ��Fe-2e-=Fe2+��������Ȧ�������٣���Ȧ��ͭ���ӵõ�������ͭ���ʸ�������Ȧ�ϣ���Ȧ�ϵĵ缫��ӦʽΪ��Cu2++2e-=Cu�������ţ�������Ȧ�������ӣ����Թ۲쵽�������ǣ���Ȧ������б,��Ȧ������б���ʺ���ѡ����D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ���ֱ���NaA��Һ��MCl��Һ�м��������NaOH��Һ�������Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ������˵������ȷ����
ʱ���ֱ���NaA��Һ��MCl��Һ�м��������NaOH��Һ�������Һ��pH������Ũ�ȱ仯��ϵ��ͼ��ʾ������˵������ȷ����

A.![]()
B.![]() ��ʱ����Һ��ˮ�ĵ���̶���ͬ
��ʱ����Һ��ˮ�ĵ���̶���ͬ
C.����![]() ��ʾ
��ʾ ��pH�ı仯��ϵ
��pH�ı仯��ϵ
D.![]() ��Һ�д��ڣ�
��Һ�д��ڣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2HBr(g)![]() Br2(g)+H2(g)�������ֲ�ͬ�������½��У�Br2��H2��ʼ��Ũ��Ϊ0����Ӧ��HBr��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
Br2(g)+H2(g)�������ֲ�ͬ�������½��У�Br2��H2��ʼ��Ũ��Ϊ0����Ӧ��HBr��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
ʵ����� | ʵ���¶� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800�� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800�� | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800�� | C3 | 0.92 | 0.63 | 0.60 | 0.60 | 0.60 | |
4 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
����˵����ȷ���ǣ� ��
A.���ϱ����ݷ�����2HBr(g)![]() Br2(g)+H2(g)����ӦΪ���ȷ�Ӧ
Br2(g)+H2(g)����ӦΪ���ȷ�Ӧ
B.ʵ��2��HBr�ij�ʼŨ��C2��1.0 mol/L
C.ʵ��3��Ӧ����С��ʵ��1�ķ�Ӧ����
D.ʵ��4һ��ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)��3B(g)![]() 4C(g)��2D(g)���ڲ�ͬ�����·�Ӧ����ƽ����Ӧ����v(X)���£����з�Ӧ���������ǡ�(����)
4C(g)��2D(g)���ڲ�ͬ�����·�Ӧ����ƽ����Ӧ����v(X)���£����з�Ӧ���������ǡ�(����)
A.v(A)=0.4mol/(L��s)B.v(B)=0.8mol/(L��s)C.v(C)=1.2mol/(L��s)D.v(D)=0.7mol/(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)д�����и�������ˮ�еĵ��뷽��ʽ��
��NH3H2O__________________
��NaHSO4____________________
��NaHCO3____________________
��Fe2(SO4)3__________________
(2)ij�¶��£���ˮ�е�c(H+)=2.0��10-7mol/L�����ʱ��Һ��c(OH-)Ϊ__________�����¶Ȳ��䣬����ϡ����ʹc(H+)=5.0��10-6mol/L����c(OH-)Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ʽ��NaHB��ˮ��Һ�д������б仯����NaHB===Na����HB������HB��![]() H����B2������HB����H2O
H����B2������HB����H2O![]() H2B��OH��������Һ��c(B2��)>c(H2B)��������˵��һ����ȷ����(����)
H2B��OH��������Һ��c(B2��)>c(H2B)��������˵��һ����ȷ����(����)
A. 0.01 mol��L��1��NaHB��Һ����pH����Ϊ2
B. NaHB��H2B��Ϊǿ�����
C. ����ʽ����Һ��ˮ�������������Ũ��С�ڴ�ˮ��ˮ�������������Ũ�ȡ�
D. HB���ĵ���̶�С��HB����ˮ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������NO2��SO2���巢����Ӧ��NO2��g��+SO2��g��![]() SO3��g��+NO��g�� ��H=-41.8kJ��mol-1
SO3��g��+NO��g�� ��H=-41.8kJ��mol-1
��NO2��SO2�������1:2�����ܱ������з���������Ӧ,������˵���÷�Ӧ�ﵽƽ��״̬����
A����ϵѹǿ���ֲ��� B�����������ɫ���ֲ���
C��SO3��NO������ȱ��ֲ��� D��ÿ����1molSO3��ͬʱ����1molNO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������ǿ����е�CO��NO��NO2����Ⱦ�����ڴ����з�Ӧ����PM2.5 ������о�NO��NO2��CO ����Ⱦ��Ĵ������Ի�����������Ҫ�����塣
(1)��֪��
NO2(g)+CO(g) = CO2 (g)+NO(g) ��H =��230.0kJ��mol-1
N2 (g)+O2 (g) = 2NO(g) ��H =��180.0 kJ��mol-1
2NO(g)+O2 (g) = 2NO2 (g) ��H =��112.3kJ��mol-1
��NO2�����CO ���巴Ӧ��������Ⱦ���壬���Ȼ�ѧ����ʽΪ_____��
(2) ��CO����CO2�Ļ�ѧ����ʽΪCO��O2![]() CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������֪ijһ�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=0.40��K��=1.24��105 L��s-1��mol-1����ʱK��=_____L��s-1��mol-1��
CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������֪ijһ�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=0.40��K��=1.24��105 L��s-1��mol-1����ʱK��=_____L��s-1��mol-1��
(3)�������������ϰ�װ����ת���������䷴Ӧ���Ȼ�ѧ����ʽΪ��2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ��H<0��T��ʱ���������ʵ�����NO ��CO �����ݻ�Ϊ2L ���ܱ������У����¶Ⱥ�������䣬��Ӧ������(0��15min) NO �����ʵ�����ʱ��仯��ͼ��
2CO2(g)+N2(g) ��H<0��T��ʱ���������ʵ�����NO ��CO �����ݻ�Ϊ2L ���ܱ������У����¶Ⱥ�������䣬��Ӧ������(0��15min) NO �����ʵ�����ʱ��仯��ͼ��
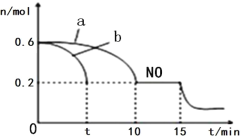
��ͼ��a��b �ֱ��ʾ����ͬ�¶��£�ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n (NO)�ı仯���ߣ����б�ʾ����������ϴ��������________(����a������b��) ��
��T��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=____��(����С�����һλС��)ƽ��ʱ�������¶Ȳ��䣬���������г���CO��CO2��0.2 mol����ƽ�⽫_____�ƶ���(����������������������������)
��15min ʱ�����ı���練Ӧ����������n (NO)����ͼ����ʾ�仯����ı������������_________(�δ�һ������)��
(4)NO2���ð�ˮ��������NH4NO3��25��ʱ����x mol NH4NO3����ˮ����Һ�����ԣ�ԭ����_________�����ӷ���ʽ��ʾ)�������Һ�μ�c L ��ˮ����Һ�����ԣ������μӰ�ˮ��Ũ��Ϊ_____molL��1��(NH3H2O �ĵ���ƽ�ⳣ��K =2��10��5 molL��1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����![]()
A.���к��Ȳⶨʵ���У�Ϊȷ��÷�Ӧǰ����²Ӧ���ѷֱ����¶ȵ�����������Һ�������ڸ��ȵ������п��ٻ�ϣ������Ͻ��裬���¶ȼƲ������Һ������¶�
B.�������ҵĽ���Һ�м����������ˮ����֤![]() ��ȫ����Ϊ
��ȫ����Ϊ![]()
C.�����������������ػ��Һ���ȣ��ٵμ���������Һ���۲��е���ɫ�������ɣ���֤���������к�����
D.��ϴ��ʽ�ζ���ʱӦ�ӵζ����Ͽڼ���![]() ��Ҫʢװ������Һ����б��ת���ζ��ܣ�ʹҺ����ʪ���ڱڣ��ٴ��Ͽڵ������ظ�
��Ҫʢװ������Һ����б��ת���ζ��ܣ�ʹҺ����ʪ���ڱڣ��ٴ��Ͽڵ������ظ�![]() ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com