
【题目】雾霾天气的“罪魁祸首”是空气中的CO、NO、NO2等污染气体在大气中反应产生PM2.5 颗粒物,研究NO、NO2、CO 等污染物的处理,对环境保护有重要的意义。
(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为_____。
(2) 由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
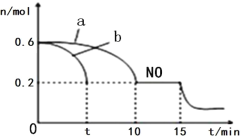
①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”) 。
②T℃时,该反应的化学平衡常数K=____;(保留小数点后一位小数)平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_____移动。(填“向左”、“向右”或“不”)
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_________(任答一条即可)。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是_________用离子方程式表示)。向该溶液滴加c L 氨水后溶液呈中性,则所滴加氨水的浓度为_____molL﹣1。(NH3H2O 的电离平衡常数K =2×10﹣5 molL﹣1)
【答案】2NO2(g)+4CO(g) = 4CO2(g)+N2(g) △H=-852.3KJ/mol 3.1×105 b 40 L/mol 向右 增加 CO 的物质的量浓度减少生成物浓度或降温 NH4 + + H2 O![]() NH3·H2O+ H+
NH3·H2O+ H+ ![]()
【解析】
(1)根据盖斯定律写出热化学方程式;
(2)当v正= v逆时,反应达到平衡状态,K逆·c(CO2) ·c(O)= K正·c(CO) ·c(O2),则![]() =
= ![]() =K;
=K;
(3)①催化剂的表面积越大,催化效果越好,反应速率越大,反应时间越短;
②用三段式计算K,用Q和K的大小判断平衡移动方向
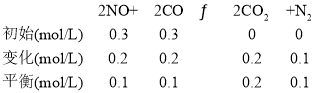
K=![]() =
=![]() =40;再向容器中充入CO、CO2各0.2 mol,Q=
=40;再向容器中充入CO、CO2各0.2 mol,Q=![]() =22.5,则平衡正向移动;
=22.5,则平衡正向移动;
③15min 时,若改变外界反应条件,导致n (NO)减小,反应正向进行,且改变条件瞬时n (NO)未变;
(4)NH4NO3为强酸弱碱盐,溶液中的铵根离子水解显酸性;向该溶液滴加c L 氨水后溶液呈中性,则c(H+)= c(OH-),根据溶液呈电中性,求出c(NH4+),根据K = 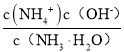 ,计算原氨水的浓度;
,计算原氨水的浓度;
(1)若NO2气体和CO 气体反应生成无污染气体,反应式:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g),①NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1,②N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1,③2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1,则4①-2②+③即可,△H=-230.0![]() -(-180.0)+(-112.3)=-852.3kJ/mol;答案为:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g) △H=-852.3kJ/mol;
-(-180.0)+(-112.3)=-852.3kJ/mol;答案为:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g) △H=-852.3kJ/mol;
(2)当v正= v逆时,反应达到平衡状态,K逆·c(CO2) ·c(O)= K正·c(CO) ·c(O2),则![]() =
= ![]() =K,K逆=
=K,K逆=![]() = 3.1×105;
= 3.1×105;
(3)①催化剂的表面积越大,催化效果越好,反应速率越大,反应时间越短,则答案为b;
②T℃时,
K=![]() =
=![]() =40;
=40;
再向容器中充入CO、CO2各0.2 mol,Q=![]() =22.5,则平衡正向移动;
=22.5,则平衡正向移动;
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,反应正向进行,且改变条件瞬时n (NO)未变,则增加 CO 的物质的量浓度减少生成物浓度或降温;
(4)NH4NO3为强酸弱碱盐,溶液中的铵根离子水解显酸性,离子反应为:NH4+ + H2 O=NH3·H2O+ H+;向该溶液滴加c L 氨水后溶液呈中性,则c(H+)= c(OH-),根据溶液呈电中性,c(NH4+)+c(H+)= c(OH-)+c(NO3-),可知c(NH4+)= c(NO3-),K = 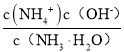 ,设混和溶液的体积为V,则c(NH4+)= c(NO3-)=
,设混和溶液的体积为V,则c(NH4+)= c(NO3-)=![]() ,此时溶液呈中性,c(OH-)=10-7mol/L,原氨水的浓度=
,此时溶液呈中性,c(OH-)=10-7mol/L,原氨水的浓度=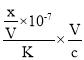 =
=![]() ;
;


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A. 甲基环己烷的一氯代物有4种
B. 甲苯(C7H8)和甘油(C3H8O3)二者以任意比例混合,当总质量一定时,充分燃烧生成水的质量是不变的
C. 某烃的结构简式可表示为![]() (碳原子数≤10),已知烃分子中有两种化学环境 不同的氢原子,则该烃一定是苯的同系物
(碳原子数≤10),已知烃分子中有两种化学环境 不同的氢原子,则该烃一定是苯的同系物
D. 分子式为C5H10O2的有机物只能含有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式(或离子方程式)说明:
盐碱地产生碱性的原因:______________________________;
(2)请用离子方程式表示明矾净水的原理:_______________________
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n(填“>”“<”或“=”)。
(4)25℃时,将amol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”)。
(5)如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是_____________。
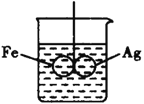
A.铁圈和银圈左右摇摆不定 B.铁圈和银圈保持平衡状态
C.铁圈向下倾斜,银圈向上倾斜 D.银圈向下倾斜,铁圈向上倾斜
写出银圈上的电极反应式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为2∶1的是 ( )
A.在反应2FeCl3+Fe =3FeCl2中还原产物与氧化产物的质量
B.相同温度下,0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s) = C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2SO2(g)+O2(g) ![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
C.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D.已知2C(s)+2O2(g) = 2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
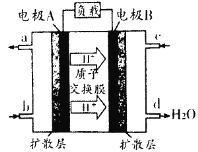
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式______________
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积Ksp=10-12(mol/L)4,当Cr3+浓度小于![]() mol
mol![]() 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中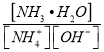 ________(填“增大”“减小”或“不变”);
________(填“增大”“减小”或“不变”);![]() 时,NH3H2O的电离平衡常数Kb=1.8×10-5mol/L,该温度下,1mol
时,NH3H2O的电离平衡常数Kb=1.8×10-5mol/L,该温度下,1mol![]() 的NH4Cl溶液中c(H+)=_______mol/L。(已知
的NH4Cl溶液中c(H+)=_______mol/L。(已知![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
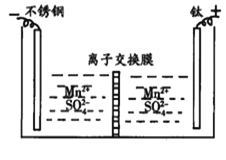
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)△H=+100kJ/mol的能量变化如图所示,判断下列叙述中正确的是
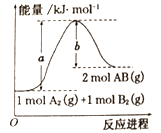
A. 加入催化剂,该反应的反应热△H将减小
B. 每生成2molA-B键,将吸收bkJ能量
C. 每生成2分子AB吸收(a-b)kJ能量
D. 该反应正反应的活化能大于100kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com