
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
【答案】D
【解析】
此题解题所需的信息都在图中,所以解答各选项时,应从图中选择合适的点,然后提取数据进行分析。
A. 选择pH=6的点,此时δ(H2PO4-)=0.95,δ(HPO42-)=0.05,Ka2(H3PO4)=![]() ,数量级为10-8,A正确;
,数量级为10-8,A正确;
B. 选择pH=7.5的点,此时δ(H2PO4-)=0.33,δ(HPO42-)=0.67,Kh(HPO42-)=![]() =1.0×10-6.8,B正确;
=1.0×10-6.8,B正确;
C. pH=7时,δ(H2PO4-)=0.65,δ(HPO42-)=0.35,c(H2PO4-)>c(HPO42-),C正确;
D. NaH2PO4溶液中,H2PO4-的电离程度小,c(H2PO4-)>c(HPO42-),从图中可以看出, pH<7时,溶液显酸性,D错误;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二甲胺是农药螟铃畏的重要中间体,在一定温度压强及催化剂条件下由氨与甲醇作用而制得,反应原理为:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)写出CH3OH(g)与NH3(g)转化为CH3NHCH3(g)和H2O(g)的热化学方程式是____________。
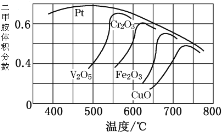
(2)不同的催化剂对二甲胺合成催化效率不同(如图所示),则最合适的催化剂及温度是_____________
(3)一定条件下,原料气中n(CH3OH)/n(NH3)比值和温度对NH3平衡转化率影响的实验数据如图:
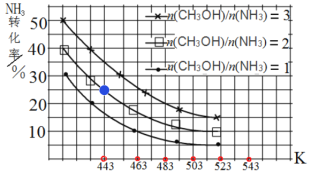
①温度为443 K时,在1 L反应容器中投入4 mol NH3和8 mol CH3OH进行反应,试计算达到平衡时CH3NHCH3(g)浓度为_________molL-1,该温度下化学平衡常数为_____________
②结合图中数据,归纳 NH3平衡转化率受外界条件影响的变化规律:a:_______b:________
(4)二甲胺水溶液类似于氨水,呈碱性;则二甲胺在水中的电离方程式为__________
(5)常温下,将二甲胺和盐酸等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | 二甲胺浓度(mol.L-1) | 盐酸浓度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①实验甲中,a______(填“大于”、“小于”或“等于”)7
②实验丙混合后的溶液中离子浓度大小关系为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
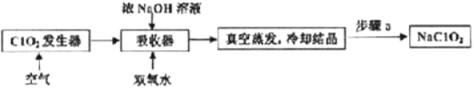
下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。

下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料.
(1)下表是当反应器中按![]() :
:![]() :3投料后,在
:3投料后,在![]() 、
、![]() 、
、![]() 下,反应达到平衡时,混合物中
下,反应达到平衡时,混合物中![]() 的物质的量分数随压强的变化曲线.
的物质的量分数随压强的变化曲线.
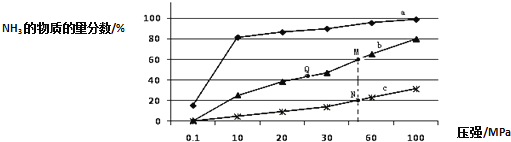
![]() 曲线a对应的温度是 ______ .
曲线a对应的温度是 ______ .
![]() 关于工业合成氨的反应,下列叙述正确的是 ______
关于工业合成氨的反应,下列叙述正确的是 ______ ![]() 填字母
填字母![]() .
.
A.及时分离出![]() 可以提高
可以提高![]() 的平衡转化率
的平衡转化率
B.加催化剂能加快反应速率且提高![]() 的平衡转化率
的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是![]()
![]() 点对应的
点对应的![]() 转化率是 ______ .
转化率是 ______ .
(2)工业制硫酸的尾气中含较多的![]() ,为防止污染空气,回收利用
,为防止污染空气,回收利用![]() ,工业上常用氨水吸收法处理尾气.
,工业上常用氨水吸收法处理尾气.
![]() 当氨水中所含氨的物质的量为3mol,吸收标准状况下
当氨水中所含氨的物质的量为3mol,吸收标准状况下![]()
![]() 时,溶液中的溶质为 ______ .
时,溶液中的溶质为 ______ .
![]() 溶液显酸性.用氨水吸收
溶液显酸性.用氨水吸收![]() ,吸收液显中性时,溶液中离子浓度关系正确的是 ______
,吸收液显中性时,溶液中离子浓度关系正确的是 ______ ![]() 填字母
填字母![]() .
.
![]()
![]()
![]()
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
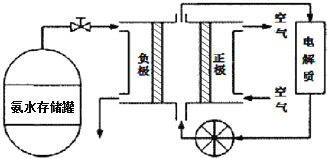
![]() 氨气燃料电池的电解质溶液最好选择 ______
氨气燃料电池的电解质溶液最好选择 ______ ![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() 溶液.
溶液.
![]() 空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
![]() 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应aA(g)+bB(g)![]() cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
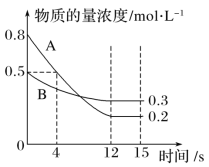
(1)从反应开始到12s时,用A表示的反应速率为___。
(2)经测定,前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为___。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测量三个容器中的反应速率分别为甲:v(A)=0.3mol·L-1·s-1,乙:v(B)=0.12mol·L-1·s-1,丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明![]() 已达平衡状态的是( )
已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v
⑤c(HI): c(H2): c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A.②③④⑤⑥B.②⑥⑦8⑨C.①②⑥④⑧D.②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓![]() ,
,![]() 不变
不变
B.含有AgCl和AgI固体的悬浊液:![]()
C.pH相同的![]() 三种溶液的
三种溶液的![]() :
:![]()
D.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com