
【题目】二甲胺是农药螟铃畏的重要中间体,在一定温度压强及催化剂条件下由氨与甲醇作用而制得,反应原理为:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)写出CH3OH(g)与NH3(g)转化为CH3NHCH3(g)和H2O(g)的热化学方程式是____________。
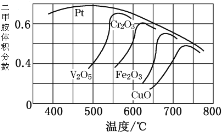
(2)不同的催化剂对二甲胺合成催化效率不同(如图所示),则最合适的催化剂及温度是_____________
(3)一定条件下,原料气中n(CH3OH)/n(NH3)比值和温度对NH3平衡转化率影响的实验数据如图:
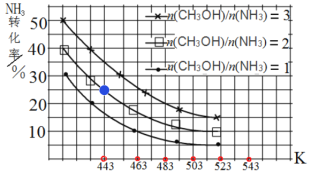
①温度为443 K时,在1 L反应容器中投入4 mol NH3和8 mol CH3OH进行反应,试计算达到平衡时CH3NHCH3(g)浓度为_________molL-1,该温度下化学平衡常数为_____________
②结合图中数据,归纳 NH3平衡转化率受外界条件影响的变化规律:a:_______b:________
(4)二甲胺水溶液类似于氨水,呈碱性;则二甲胺在水中的电离方程式为__________
(5)常温下,将二甲胺和盐酸等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | 二甲胺浓度(mol.L-1) | 盐酸浓度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①实验甲中,a______(填“大于”、“小于”或“等于”)7
②实验丙混合后的溶液中离子浓度大小关系为______________
【答案】2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g) ΔH=-1367 kJ·mol-1 Pt、500℃ 1 ![]() a:其他条件不变,NH3平衡转化率随原料
a:其他条件不变,NH3平衡转化率随原料![]() 比值增大而增大 b:其他条件不变,NH3平衡转化率随反应温度升高而减小 CH3NHCH3H2O(CH3)2NH2++OH- 小于 c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+)
比值增大而增大 b:其他条件不变,NH3平衡转化率随反应温度升高而减小 CH3NHCH3H2O(CH3)2NH2++OH- 小于 c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+)
【解析】
(1)根据盖斯定律,得到目标化学方程式。
(2)如图可知催化效率最好的物质和温度。
(3)①根据三段式建立关系进行计算;②根据图像得出规律。
(4)仿照氨气溶于水的电离方程式写CH3NHCH3H2O的电离方程式。
(5)①二甲胺是一元弱碱;②实验丙中反应后溶液中为等物质的量的CH3NHCH3H2O和(CH3)2NH2Cl,溶液呈碱性,CH3NHCH3H2O的电离程度大于(CH3)2NH2Cl的水解程度。
(1)根据盖斯定律,目标化学方程式=①×2+②×![]() -③,热化学方程式为2CH3OH(g)+NH3(g) CH3NHCH3(g)+2H2O(g) ΔH=-1367 kJ·mol-1,故答案为:2CH3OH(g)+NH3(g) CH3NHCH3(g) + 2H2O(g) ΔH=-1367 kJ·mol-1。
-③,热化学方程式为2CH3OH(g)+NH3(g) CH3NHCH3(g)+2H2O(g) ΔH=-1367 kJ·mol-1,故答案为:2CH3OH(g)+NH3(g) CH3NHCH3(g) + 2H2O(g) ΔH=-1367 kJ·mol-1。
(2)如图可知,Pt的催化效率最好且500℃达到最佳,故答案为:Pt、500℃。
(3)①443K时,NH3的转化率为25%,三段式计算为
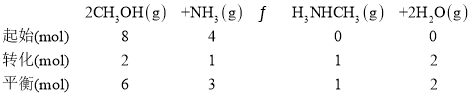 c(CH3NHCH3) =
c(CH3NHCH3) = ![]() =1mol·L-1,
=1mol·L-1,![]() ,故答案为:1;
,故答案为:1;![]() 。
。
②根据图像得出规律为a:其他条件不变,NH3平衡转化率随原料![]() 比值增大而增大;b:其他条件不变,NH3平衡转化率随反应温度升高而减小,故答案为:a:其他条件不变,NH3平衡转化率随原料
比值增大而增大;b:其他条件不变,NH3平衡转化率随反应温度升高而减小,故答案为:a:其他条件不变,NH3平衡转化率随原料![]() 比值增大而增大;b:其他条件不变,NH3平衡转化率随反应温度升高而减小。
比值增大而增大;b:其他条件不变,NH3平衡转化率随反应温度升高而减小。
(4)仿照氨气溶于水的电离方程式,CH3NHCH3H2O (CH3)2NH2++OH-,故答案为:CH3NHCH3H2O (CH3)2NH2++OH-。
(5)①二甲胺是一元弱碱,和盐酸反应生成强酸弱碱盐,则a < 7,故答案为:<。
②实验丙中反应后溶液中为等物质的量的CH3NHCH3H2O和(CH3)2NH2Cl,溶液呈碱性;
CH3NHCH3H2O的电离程度大于(CH3)2NH2Cl的水解程度,离子浓度大小顺序为:
c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+),故答案为:c[(CH3)2NH2+]>c(Cl-)>c(OH-)>c(H+)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子价电子排布式为_________。
(2)ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,而ZnI2能够溶于乙醇、乙醚等有机溶剂,ZnI2晶体类型是__________。
(3)S和O为同主族元素,但两者的简单氢化物的熔沸点差异较大,其原因为:____。
(4)化合物Cl2O的立体构型为________,O原子的杂化方式为_____,可由Cl2与湿润的Na2CO3反应可制备,其化学方程式为_______。
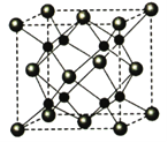
(5)Na和O能够形成某种化合物,其晶胞结构与CaF2相似,如图所示,晶胞参数边长a cm,晶胞中O原子的配位数为_______;列式计算该晶体的密度(g·cm-3)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1NaOH溶液分别滴定20.00mL0.100mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
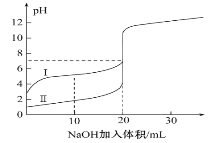
A.Ⅰ表示的是滴定盐酸的曲线
B.醋酸的电离平衡常数K=1×10-5
C.pH>7时,滴定醋酸消耗V(NaOH)一定大于20mL
D.V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )

A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不符合节能减排要求的是( )
A.将煤块粉碎提高燃料的燃烧效率
B.在汽车上安装汽车尾气催化转化装置,可使汽车尾气中的![]() 和
和![]() 发生反应:
发生反应:![]()
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些汽车安装了安全气囊,气囊中装有叠氮化钠(![]() )等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(
)等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(![]() ),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
(1)写出叠氮化钠发生分解反应的化学方程式:____________________。
(2)写出安全气囊中选用叠氮化钠的理由:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com