
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子价电子排布式为_________。
(2)ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,而ZnI2能够溶于乙醇、乙醚等有机溶剂,ZnI2晶体类型是__________。
(3)S和O为同主族元素,但两者的简单氢化物的熔沸点差异较大,其原因为:____。
(4)化合物Cl2O的立体构型为________,O原子的杂化方式为_____,可由Cl2与湿润的Na2CO3反应可制备,其化学方程式为_______。
(5)Na和O能够形成某种化合物,其晶胞结构与CaF2相似,如图所示,晶胞参数边长a cm,晶胞中O原子的配位数为_______;列式计算该晶体的密度(g·cm-3)_____。
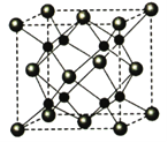
【答案】3d104s2 分子晶体 水分子间有氢键 V形 sp3 2Cl2+Na2CO3=Cl2O+CO2+2NaCl 8 ![]()
【解析】
(1)Zn是30号元素,根据构造原理书写其核外电子排布式,进而可得其价层电子排布式;
(2)根据不同晶体类型的物理性质的区别分析判断;
(3)H2O分子之间存在氢键;
(4)根据价层电子对数判断O原子杂化类型,根据价层电子对互斥理论判断分子空间构型;Cl2与湿润的Na2CO3反应产生Cl2O、CO2及NaCl,据此书写反应方程式;
(5)根据晶胞结构判断配位数,利用晶胞的密度计算公式ρ=![]() 计算晶胞密度。
计算晶胞密度。
(1)Zn是30号元素,核外电子排布式为1s22s22p63s23p63d104s2,其价层电子排布式是3d104s2。
(2)离子晶体熔沸点较高,易溶于水,不易溶于有机溶剂;由非极性分子组成的溶质易溶于由非极性分子组成的溶剂中。ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,说明ZnF2是离子晶体;而ZnI2能够溶于乙醇、乙醚等有机溶剂,则说明ZnI2是由分子构成的物质,其在固态时晶体类型是分子晶体。
(3)S和O为同主族元素,二者形成氢化物构型相同分别是H2S、H2O。由于O原子半径小,元素非金属性强,在H2O分子之间除存在分子间作用力外还存在氢键,氢键的存在增加了分子之间的吸引作用,使物质的熔沸点较高,而在H2S分子之间只存在分子间作用力,因此H2O的熔沸点比H2S的高。
(4)在化合物Cl2O中,O原子价层电子对数为2+![]() =4,所以O原子杂化类型为sp3杂化,O原子采用sp3杂化,Cl2O的VSEPR模型为四面体形,由于O原子上有2个孤对电子,占据2个轨道,因此该分子立体构型为V形。Cl2O可由Cl2与湿润的Na2CO3反应可制备,根据原子守恒,反应还产生了CO2及NaCl,该反应的化学方程式为2Cl2+Na2CO3=Cl2O+CO2+2NaCl。
=4,所以O原子杂化类型为sp3杂化,O原子采用sp3杂化,Cl2O的VSEPR模型为四面体形,由于O原子上有2个孤对电子,占据2个轨道,因此该分子立体构型为V形。Cl2O可由Cl2与湿润的Na2CO3反应可制备,根据原子守恒,反应还产生了CO2及NaCl,该反应的化学方程式为2Cl2+Na2CO3=Cl2O+CO2+2NaCl。
(5)氧和钠能够形成的某种化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则Na+的个数为8,O2-的个数为8×![]() +6×
+6×![]() =4,N(Na):N(O)=2:1,所以形成的化合物为Na2O;晶胞中O位于面心,每个晶胞中有4个Na与O的距离最近,每个面心O原子为2个晶胞所共有,则晶胞中O原子的配位数为8;
=4,N(Na):N(O)=2:1,所以形成的化合物为Na2O;晶胞中O位于面心,每个晶胞中有4个Na与O的距离最近,每个面心O原子为2个晶胞所共有,则晶胞中O原子的配位数为8;
根据晶胞密度公式ρ=![]() ,可得晶胞密度ρ=
,可得晶胞密度ρ=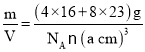 =
=![]() g/cm3。
g/cm3。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下,将![]() 缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人
缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人![]() 溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )
溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )

A.曲线③④段有离子反应:![]()
B.可依据②处数据计算所溶解的![]()
C.③处表示氯气与氢氧化钠溶液恰好反应完全
D.①处![]() 约为
约为![]() 处
处![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
A. 与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积
B. 与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少
C. 深海地区石灰石岩层的溶解反应为:CaCO3(s)+H2O(l)+CO2(aq)Ca(HCO3)2(aq)
D. 海水呈弱酸性,大气中CO2浓度增加,会导致海水中CO![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。

③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,![]() 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 ![]()
![]()
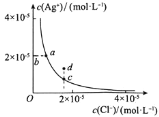
A.a点加入少量氯化钠固体,平衡逆向移动,Ag+、Cl-浓度均减小
B.加入少量水,平衡右移,Cl-浓度减小
C.d点有AgCl沉淀生成
D.d点加水稀释可以到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36,Ksp(MnS)=2.5×10-13,常温下三种物质在水中的沉淀溶解平衡线如图所示(X表示Fe、Cu、Mn)。下列说法正确的是( )

A.曲线Ⅰ表示CuS的溶解平衡曲线
B.Ag2S在a点溶液中的溶解度小于在b点溶液中的溶解度
C.c点与d点溶液中S2-的物质的量浓度相等
D.向含有XS固体的d点溶液中滴加稀硫酸至过量可使固体逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.0L的恒容密闭容器中进行可逆反应:![]() 。判断该可逆反应达到平衡状态的依据有( )
。判断该可逆反应达到平衡状态的依据有( )
A.单位时间内消耗X和Y的物质的量之比为1:2
B.容器内气体的压强不再随时间改变
C.容器内气体的密度不再随时间改变
D.气体Z的物质的量不再随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.1 molNaN3所含阴离子总数为3NA
B.常温下,1L pH=1的H2SO4溶液和1L pH=1的NH4Cl溶液中由水电离的H+均为0.1NA
C.1mol![]() 分子中最多共面的碳原子数为9NA
分子中最多共面的碳原子数为9NA
D.标准状况下,4.48L C12通入通入水中,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲胺是农药螟铃畏的重要中间体,在一定温度压强及催化剂条件下由氨与甲醇作用而制得,反应原理为:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)写出CH3OH(g)与NH3(g)转化为CH3NHCH3(g)和H2O(g)的热化学方程式是____________。
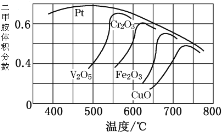
(2)不同的催化剂对二甲胺合成催化效率不同(如图所示),则最合适的催化剂及温度是_____________
(3)一定条件下,原料气中n(CH3OH)/n(NH3)比值和温度对NH3平衡转化率影响的实验数据如图:
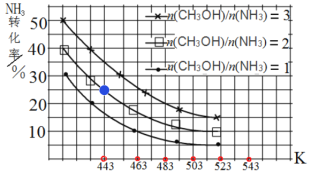
①温度为443 K时,在1 L反应容器中投入4 mol NH3和8 mol CH3OH进行反应,试计算达到平衡时CH3NHCH3(g)浓度为_________molL-1,该温度下化学平衡常数为_____________
②结合图中数据,归纳 NH3平衡转化率受外界条件影响的变化规律:a:_______b:________
(4)二甲胺水溶液类似于氨水,呈碱性;则二甲胺在水中的电离方程式为__________
(5)常温下,将二甲胺和盐酸等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | 二甲胺浓度(mol.L-1) | 盐酸浓度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①实验甲中,a______(填“大于”、“小于”或“等于”)7
②实验丙混合后的溶液中离子浓度大小关系为______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com