
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.1 molNaN3所含阴离子总数为3NA
B.常温下,1L pH=1的H2SO4溶液和1L pH=1的NH4Cl溶液中由水电离的H+均为0.1NA
C.1mol![]() 分子中最多共面的碳原子数为9NA
分子中最多共面的碳原子数为9NA
D.标准状况下,4.48L C12通入通入水中,转移的电子数为0.2NA
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子价电子排布式为_________。
(2)ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,而ZnI2能够溶于乙醇、乙醚等有机溶剂,ZnI2晶体类型是__________。
(3)S和O为同主族元素,但两者的简单氢化物的熔沸点差异较大,其原因为:____。
(4)化合物Cl2O的立体构型为________,O原子的杂化方式为_____,可由Cl2与湿润的Na2CO3反应可制备,其化学方程式为_______。
(5)Na和O能够形成某种化合物,其晶胞结构与CaF2相似,如图所示,晶胞参数边长a cm,晶胞中O原子的配位数为_______;列式计算该晶体的密度(g·cm-3)_____。
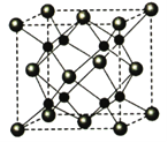
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是![]()
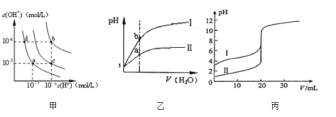
A.图甲中纯水仅升高温度,就可以从a点变到c点
B.图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C.图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D.图丙表示25℃时用0.100molL-1NaOH溶液分别滴定20.00ml0.100molL-1的盐酸和醋酸,V(NaOH)=20.00ml时,两份溶液中c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子反应的说法正确的是( )
选项 | 离子方程式 | 评价 |
A | 将2molCl2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2= 2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ | 正确;阳极氯离子放电,阴极氢离子放电 |
C | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2一 + 4NH4++ 2H2O | 正确;氨水过量,氢氧化铝能溶于过量的碱 |
D | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | 错误;电荷不守恒,生成物中应有亚铁离子 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1NaOH溶液分别滴定20.00mL0.100mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
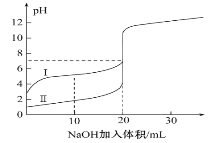
A.Ⅰ表示的是滴定盐酸的曲线
B.醋酸的电离平衡常数K=1×10-5
C.pH>7时,滴定醋酸消耗V(NaOH)一定大于20mL
D.V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )

A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些汽车安装了安全气囊,气囊中装有叠氮化钠(![]() )等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(
)等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(![]() ),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
(1)写出叠氮化钠发生分解反应的化学方程式:____________________。
(2)写出安全气囊中选用叠氮化钠的理由:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com