
【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。

③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
【答案】ΔH 4-2ΔH2 -ΔH 3 减小 < > C 规律:其他条件不变时,随压强(压力)增大,甲醇转化率降低,原因:压强增大,催化剂吸附水分子的量增多,催化效率降低,相同时间里转化量减少,甲醇转化率降低。 (说明:如规律写错,解释不给分) CH3OCH3—12e-+3H2O=2CO2+12H+ 9.6
【解析】
(1)根据盖斯定律计算;
(2)①lnKp= - 2.205+(2708.6137/T),升高温度lnKp减小,则Kp减小,平衡逆向移动;
②Qp与Kp的关系判断;
③根据lnKp= - 2.205+(2708.6137/T),计算Kp,若催化剂对水蒸气无影响时和催化剂对水蒸气有影响计算P(CH3OCH3)及 CH3OCH3(g)的物质的量分数;
④根据图像可知,温度相同时,随压强的增大,甲醇转化率降低,压强增大,催化剂吸附H2O(g)的量会受压强影响;
(3)①二甲醚燃料电池中,二甲醚失电子,化合价升高,作电池的负极,电解质溶液显酸性,则生成二氧化碳和氢离子;
②根据转移电子数目守恒计算。
(1)①2H2(g)+CO(g)CH3OH(g) ΔH2 ②CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 ③3H2(g)+3CO(g) CH3OCH3(g) +CO2(g) ΔH4,根据盖斯定律,③-②-2①,可得2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH1=ΔH4-2ΔH2 -ΔH 3;
(2)①lnKp= - 2.205+(2708.6137/T),升高温度lnKp减小,则Kp减小,平衡逆向移动,转化成CH3OCH3(g)的倾向减小;ΔH1<0,则ΔH4<2ΔH2 -ΔH 3;
②Qp= ![]() =
=![]() =1<100,平衡正向进行,则V正>V逆;
=1<100,平衡正向进行,则V正>V逆;
③若初始投入的甲醇完全反应时,生成等量的二甲醚和水,二甲醚占据的物质的量分数为![]() ;lnKp= - 2.205+(2708.6137/T),温度为200℃时,Kp=33.78,若催化剂对水蒸气无影响时,且P(CH3OH)=1,则P(CH3OCH3)=5.8,压强之比等于物质的量之比,CH3OCH3(g)的物质的量分数为
;lnKp= - 2.205+(2708.6137/T),温度为200℃时,Kp=33.78,若催化剂对水蒸气无影响时,且P(CH3OH)=1,则P(CH3OCH3)=5.8,压强之比等于物质的量之比,CH3OCH3(g)的物质的量分数为![]() =0.46,答案为C;
=0.46,答案为C;
④根据图像可知,温度相同时,随压强的增大,甲醇转化率降低,压强增大,催化剂吸附H2O(g)的量会受压强影响,导致催化剂吸附水分子的量增多,催化效率降低,相同时间里转化量减少,甲醇转化率降低。
(3)①二甲醚燃料电池中,二甲醚失电子,化合价升高,作电池的负极,电解质溶液显酸性,则生成二氧化碳和氢离子,电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+;
②消耗2.3g二甲醚时,转移电子的物质的量为0.05×12=0.6mol,铜离子得电子生成单质铜,生成![]() =0.15molCu,即9.6g。
=0.15molCu,即9.6g。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度 | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5 mol、1.8 mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
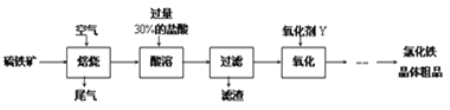
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
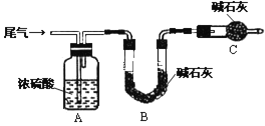
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
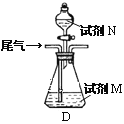
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子价电子排布式为_________。
(2)ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,而ZnI2能够溶于乙醇、乙醚等有机溶剂,ZnI2晶体类型是__________。
(3)S和O为同主族元素,但两者的简单氢化物的熔沸点差异较大,其原因为:____。
(4)化合物Cl2O的立体构型为________,O原子的杂化方式为_____,可由Cl2与湿润的Na2CO3反应可制备,其化学方程式为_______。
(5)Na和O能够形成某种化合物,其晶胞结构与CaF2相似,如图所示,晶胞参数边长a cm,晶胞中O原子的配位数为_______;列式计算该晶体的密度(g·cm-3)_____。
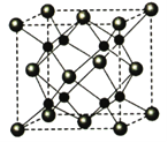
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )

A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com