
【题目】常温下,将![]() 缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人
缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人![]() 溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )
溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )

A.曲线③④段有离子反应:![]()
B.可依据②处数据计算所溶解的![]()
C.③处表示氯气与氢氧化钠溶液恰好反应完全
D.①处![]() 约为
约为![]() 处
处![]() 的两倍
的两倍
【答案】A
【解析】
![]() 曲线从
曲线从![]() 到
到![]() ,溶液PH增大,说明此段发生反应:
,溶液PH增大,说明此段发生反应:![]() 、
、![]() ,离子反应分别为:
,离子反应分别为:![]() 、
、![]() ,
,![]() 点此时
点此时![]() ,
,![]() ,HClO为弱电解质,部分电离,此时溶液中存在次氯酸的电离平衡,从
,HClO为弱电解质,部分电离,此时溶液中存在次氯酸的电离平衡,从![]() 到
到![]() 图象分析可知:溶液PH继续增大,且PH大于7,继续加氢氧化钠,氢氧化钠和次氯酸反应,
图象分析可知:溶液PH继续增大,且PH大于7,继续加氢氧化钠,氢氧化钠和次氯酸反应,![]() ,生成的次氯酸钠为强碱弱酸盐,水解呈碱性,加碱直至碱过量PH继续增大,所以离子反应为:
,生成的次氯酸钠为强碱弱酸盐,水解呈碱性,加碱直至碱过量PH继续增大,所以离子反应为:![]() ,选项A正确;
,选项A正确;
B.![]() 点所示溶液中发生反应:
点所示溶液中发生反应:![]() ,HClO为弱电解质,部分电离,无法根据pH计算参加反应的氯气,选项B错误;
,HClO为弱电解质,部分电离,无法根据pH计算参加反应的氯气,选项B错误;
C.氯气与氢氧化钠恰好反应完全溶液为氯化钠、次氯酸钠溶液,溶液呈碱性,![]() 点所示溶液中发生反应:
点所示溶液中发生反应:![]() 、
、![]() ,溶液呈中性,
,溶液呈中性,![]() ,选项C错误;
,选项C错误;
D.![]() 处到
处到![]() 处是氯气的溶解平衡:
处是氯气的溶解平衡:![]() 向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,选项D错误;
向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】写出下列有机反应的化学方程式
(1)麦芽糖的水解反应_______________________________________________________
(2)实验室制乙烯的反应_______________________________________________________
(3)乙醛和新制氢氧化铜的反应__________________________________________________
(4)乙二醇与乙二酸缩聚反应_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷(C10H16)的结构如图1所示,它可以看成四个等同的六元环组成的空间构型。立方烷(C8H8)的结构如图2所示。其中金刚烷的二氯代物和立方烷的六氯代物的同分异构体分别是 ( )
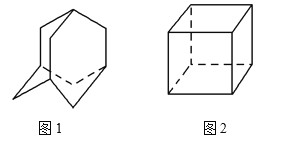
A. 4种和1种 B. 5种和3种
C. 6种和3种 D. 6种和4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在由水电离产生的氢离子浓度为10-13mol/L的溶液中,Ca2+、K+、Cl-、HCO3-四种离子能大量共存
B.常温下,将0.2mol/L某一元碱ROH溶液和0.1mol/LHCl溶液等体积混合,混合后溶液pH<7,则该溶液c(ROH)>c(R+)
C.反应![]() 只在高温下自发进行
只在高温下自发进行
D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有:![]() ,且
,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
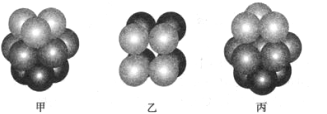
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:
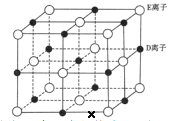
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子价电子排布式为_________。
(2)ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,而ZnI2能够溶于乙醇、乙醚等有机溶剂,ZnI2晶体类型是__________。
(3)S和O为同主族元素,但两者的简单氢化物的熔沸点差异较大,其原因为:____。
(4)化合物Cl2O的立体构型为________,O原子的杂化方式为_____,可由Cl2与湿润的Na2CO3反应可制备,其化学方程式为_______。
(5)Na和O能够形成某种化合物,其晶胞结构与CaF2相似,如图所示,晶胞参数边长a cm,晶胞中O原子的配位数为_______;列式计算该晶体的密度(g·cm-3)_____。
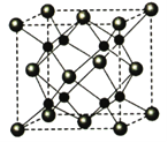
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com