
【题目】下列可以证明![]() 已达平衡状态的是( )
已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v
⑤c(HI): c(H2): c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A.②③④⑤⑥B.②⑥⑦8⑨C.①②⑥④⑧D.②⑥⑨
【答案】D
【解析】
A.③该反应是纯气体反应,所以温度和体积一定时混合气体的密度始终不变;④未指明正逆反应;⑤三种物质的浓度比等于相应的化学计量数比时不一定是平衡状态;③④⑤不能作为达到平衡状态的标志,A错误;
B.⑦温度和体积一定时,容器内压强始终不变;⑧温度和压强一定时,混合气体的平均相对分子质量始终不变;⑦⑧不能作为达到平衡状态的标志,B错误;
C.①单位时间内生成 n mol H2的同时生成 n mol HI,不符合对应的化学计量数比,C错误;
D.②一个H一H键断裂的同时有两个H一I键断裂,表明正逆反应速率相等;⑥温度和体积一定时,某一生成物浓度不再变化,符合化学平衡的定义;⑨温度和体积一定时,混合气体的颜色不再变化,说明碘的浓度不再变化,可以作为达到平衡状态的标志,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】有些汽车安装了安全气囊,气囊中装有叠氮化钠(![]() )等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(
)等固体粉末。一旦汽车发生强烈的撞击,叠氮化钠将迅速分解生成钠和氮气(![]() ),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
(1)写出叠氮化钠发生分解反应的化学方程式:____________________。
(2)写出安全气囊中选用叠氮化钠的理由:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
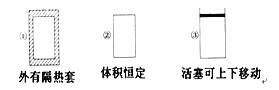
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH.己知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)= CO2(g)+2H2O(l)△H1= akJmol-1
O2(g)= CO2(g)+2H2O(l)△H1= akJmol-1
H2(g)+![]() O2(g)= H2O(l)△H2= bkJmol-1
O2(g)= H2O(l)△H2= bkJmol-1
H2O(g)= H2O(l)△H3= ckJmol-1
则CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g)△H = ______kJmol-1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)2CO(g)△H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图1所示。
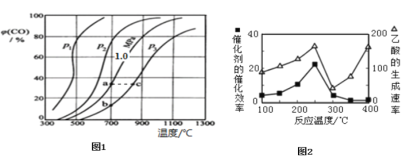
回答下列问题:
①压强p1、p2、p3的由大到小关系是______;Ka、Kb、Kc为a、b、c三点对应的平衡常数,则其大小关系是______。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为______(保留三位有效数字),该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为______;每生成3.36L(标准状况)乙烯,理论上需消耗铅蓄电池中______mol硫酸。
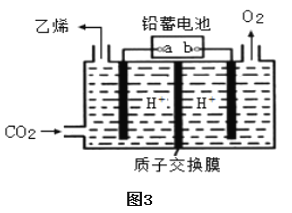
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组同学为探究氯水的成分及性质进行了如下实验:
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
实验操作(氯水均为新制) |
|
|
|
|
|
实验现象 | 蒸馏水由无色逐渐变为浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
(试管中溶液均为1mL,均滴入氯水5滴)
(1)证明氯水中含有Cl-的是实验__(填序号),用离子方程式表示该实验中涉及的反应__。
(2)由实验②的现象可推断非金属性:Cl__I(填“>”或“<”),由原子结构解释其原因:Cl和I同主族,__,得电子能力:Cl>I(请补充完整)。
(3)实验③中溶液变红是由于溶液中含有__(填微粒符号,下同);使溶液褪色的微粒是__。
(4)同学们根据“H2O2在催化剂作用下可发生分解”的性质,认为实验⑤中现象不一定说明氧化性Cl2>H2O2。为证实Cl2将H2O2氧化,可继续补充实验:__(填操作、现象)。
(5)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如图曲线。
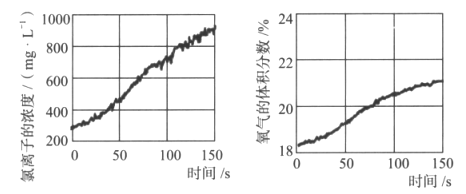
解释上两图中曲线变化的原因__。若在上述整个实验过程中测定溶液的pH,pH的变化是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com