
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH.己知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)= CO2(g)+2H2O(l)△H1= akJmol-1
O2(g)= CO2(g)+2H2O(l)△H1= akJmol-1
H2(g)+![]() O2(g)= H2O(l)△H2= bkJmol-1
O2(g)= H2O(l)△H2= bkJmol-1
H2O(g)= H2O(l)△H3= ckJmol-1
则CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g)△H = ______kJmol-1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)2CO(g)△H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图1所示。
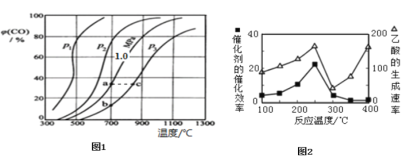
回答下列问题:
①压强p1、p2、p3的由大到小关系是______;Ka、Kb、Kc为a、b、c三点对应的平衡常数,则其大小关系是______。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为______(保留三位有效数字),该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
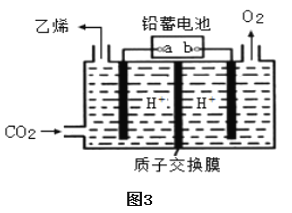
(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为______;每生成3.36L(标准状况)乙烯,理论上需消耗铅蓄电池中______mol硫酸。
【答案】![]() P3>P2>P1
P3>P2>P1 ![]()
![]()
![]()
![]() 1.8
1.8
【解析】
(1).利用盖斯定律进行计算解答;
(2).①根据反应C(s)+CO2(g)2CO(g),是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
②900℃、1.0MPa时,图像中平衡时CO的体积分数为80%,计算CO2转化的量,转化率=![]() ,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
(3)根据图知,右侧电极上OH-放电生成O2,则右侧电极为阳极,左侧电极为阴极,连接电解池阴极的电极为原电池负极、连接电解池阳极的电极为原电池正极;电解过程中阳极反应式为2H2O-4e-=O2↑+4H+,阳极附近有H+生成;阴极反应式为2CO2+12H++12e-═C2H4+4H2O,阴极上二氧化碳得电子和氢离子反应生成乙烯和水;铅蓄电池反应式为Pb+PbO2+2H2SO4═2PbSO4+2H2O,串联电路中转移电子相等,据此计算消耗硫酸物质的量。
(1).已知①CH3OH(g)+![]() O2(g)= CO2(g)+2H2O(l)△H1= akJmol-1
O2(g)= CO2(g)+2H2O(l)△H1= akJmol-1
②H2(g)+![]() O2(g)= H2O(l)△H2= bkJmol-1
O2(g)= H2O(l)△H2= bkJmol-1
③H2O(g)= H2O(l)△H3= ckJmol-1
根据盖斯定律知,②×3①③得:CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g)△H= 3bac kJ/mol;
(2).①反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大,减小压强有助于化学平衡正向移动,表明低压强对应着高的CO体积分数,则p1、p2、p3的大小关系是:p3>p2>p1;化学平衡常数只随温度的改变而改变,升高温度,正反应方向为吸热反应,正反应趋势增大,化学平衡常数增大,则a、b、c三点对应的平衡常数大小关系是:Ka=Kb<Kc;
②900℃、1.0MPa时,设反应转化的CO2的物质的量为x,列“三段式”:
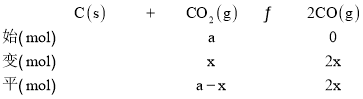
则平衡时n(CO)=2x,n(CO2)=ax,根据图像,平衡时CO的体积分数为80%,则![]() ×100%=80%,解得:x=
×100%=80%,解得:x=![]() a,
a,
则CO2的转化率为: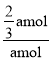 ×100%=66.7%,
×100%=66.7%,

Kp=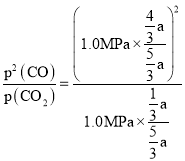 =
= ![]() ;
;
(3)阴极上二氧化碳得电子和氢离子反应生成乙烯和水,电极反应式为![]() , 铅蓄电池反应式为:Pb+PbO2+2H2SO4
, 铅蓄电池反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4↓+2H2O,串联电路中转移电子相等,生成1mol乙烯转移12mol电子,转移2mol电子消耗2mol硫酸,V乙烯=3.36L,n=
2PbSO4↓+2H2O,串联电路中转移电子相等,生成1mol乙烯转移12mol电子,转移2mol电子消耗2mol硫酸,V乙烯=3.36L,n=![]() =
=![]() =0.15mol,生成0.15mol乙烯转移1.8mol电子,转移1.8mol电子消耗1.8mol硫酸;
=0.15mol,生成0.15mol乙烯转移1.8mol电子,转移1.8mol电子消耗1.8mol硫酸;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
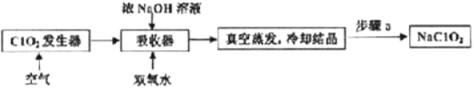
下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明![]() 已达平衡状态的是( )
已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v
⑤c(HI): c(H2): c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A.②③④⑤⑥B.②⑥⑦8⑨C.①②⑥④⑧D.②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )
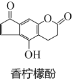
A.它的分子式为C13H9O4
B.它与H2发生加成反应,1mol最多可消耗7mol H2
C.它与溴水发生反应,1mol最多消耗3molBr2
D.它与NaOH溶液反应,1mol最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.常温下,![]() 的氢氧化钠溶液中加入10mL
的氢氧化钠溶液中加入10mL ![]() 的HA,所得溶液
的HA,所得溶液![]()
B.![]() 时,
时,![]() 与
与![]() 的氯化铵溶液的pH前者大
的氯化铵溶液的pH前者大
C.室温时浓度均为![]() 的
的![]() 和
和![]() 的混合液,pH为10,则
的混合液,pH为10,则![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓![]() ,
,![]() 不变
不变
B.含有AgCl和AgI固体的悬浊液:![]()
C.pH相同的![]() 三种溶液的
三种溶液的![]() :
:![]()
D.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①—⑥的位置回答下列问题:
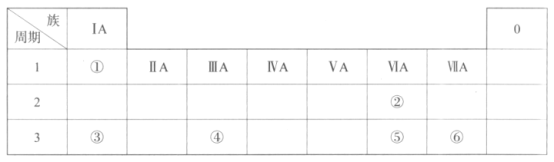
(1)元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是__。
(2)⑤的原子结构示意图是__。
(3)上述元素中,原子半径最大的是__(写元素符号)。
(4)仅由①、⑥组成的化合物的电子式为__,该化合物的分子中含有__(填“极性”或“非极性”)共价键。
(5)金属性:③__④(填“>”或“<”),列举一条能证明该结论的实验事实:__。
(6)下列说法正确的是__(填序号)。
a.②、③组成的化合物只有一种
b.②的气态氢化物稳定性高于⑤
c.⑥在化合物中呈现的最高化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。

已知:①SnCl2、SnCl4有关物理性质:

②SnCl4极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是_________________________________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________________________________;②____________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________。
(5)滴定分析产品中2价Sn(Ⅱ)的含量:用分析天平称取5.000g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000mol·L-1的碘标准溶液滴定至终点时消耗20.00mL,则产品中Sn(Ⅱ)的含量为___________。(已知Sn2++I2=2I-+Sn4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com