
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料.
(1)下表是当反应器中按![]() :
:![]() :3投料后,在
:3投料后,在![]() 、
、![]() 、
、![]() 下,反应达到平衡时,混合物中
下,反应达到平衡时,混合物中![]() 的物质的量分数随压强的变化曲线.
的物质的量分数随压强的变化曲线.
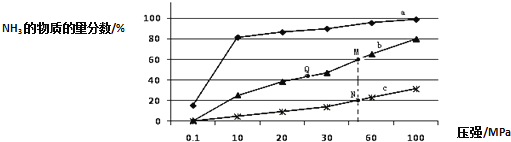
![]() 曲线a对应的温度是 ______ .
曲线a对应的温度是 ______ .
![]() 关于工业合成氨的反应,下列叙述正确的是 ______
关于工业合成氨的反应,下列叙述正确的是 ______ ![]() 填字母
填字母![]() .
.
A.及时分离出![]() 可以提高
可以提高![]() 的平衡转化率
的平衡转化率
B.加催化剂能加快反应速率且提高![]() 的平衡转化率
的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是![]()
![]() 点对应的
点对应的![]() 转化率是 ______ .
转化率是 ______ .
(2)工业制硫酸的尾气中含较多的![]() ,为防止污染空气,回收利用
,为防止污染空气,回收利用![]() ,工业上常用氨水吸收法处理尾气.
,工业上常用氨水吸收法处理尾气.
![]() 当氨水中所含氨的物质的量为3mol,吸收标准状况下
当氨水中所含氨的物质的量为3mol,吸收标准状况下![]()
![]() 时,溶液中的溶质为 ______ .
时,溶液中的溶质为 ______ .
![]() 溶液显酸性.用氨水吸收
溶液显酸性.用氨水吸收![]() ,吸收液显中性时,溶液中离子浓度关系正确的是 ______
,吸收液显中性时,溶液中离子浓度关系正确的是 ______ ![]() 填字母
填字母![]() .
.
![]()
![]()
![]()
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
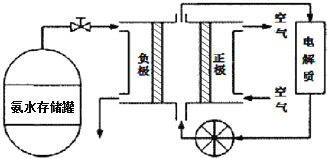
![]() 氨气燃料电池的电解质溶液最好选择 ______
氨气燃料电池的电解质溶液最好选择 ______ ![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() 溶液.
溶液.
![]() 空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
![]() 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
【答案】![]() AC
AC ![]()
![]() 和
和![]() ab 碱性
ab 碱性 ![]()
![]()
【解析】
![]() 合成氨反应放热,温度越低氨气的百分含量越高;
合成氨反应放热,温度越低氨气的百分含量越高;
![]() 、减小生成物浓度平衡正向移动;
、减小生成物浓度平衡正向移动;
B、催化剂不影响平衡移动;
C、K只受温度影响,该反应温度升高时K值减小;
![]() 利用
利用 求算;
求算;
![]() 氨的物质的量为3mol,吸收标准状况下
氨的物质的量为3mol,吸收标准状况下![]() 时.N原子3mol,S原子2mol,据原子守恒,在
时.N原子3mol,S原子2mol,据原子守恒,在![]() 中,其原子个数比N:
中,其原子个数比N:![]() :1,在中,
:1,在中,![]() ,其原子个数比N:
,其原子个数比N:![]() :1,据此分析;
:1,据此分析;
![]() 利用电荷守恒原理解答;
利用电荷守恒原理解答;
![]() 氨气是碱性气体;
氨气是碱性气体;
![]() 空气中的
空气中的![]() 能和氨水反应;
能和氨水反应;
![]() 正极发生氧化反应,氧气在正极反应,注意时碱性环境。
正极发生氧化反应,氧气在正极反应,注意时碱性环境。
![]() 合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是
合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是![]() ,
,
故答案为:![]() ;
;
![]() 、减小生成物浓度平衡正向移动,及时分离出
、减小生成物浓度平衡正向移动,及时分离出![]() 可以提高
可以提高![]() 的平衡转化率,故A正确;
的平衡转化率,故A正确;
B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高![]() 的平衡转化率,故B错误;
的平衡转化率,故B错误;
C、K只受温度影响,该反应温度升高时K值减小,b是![]() ,c是
,c是![]() ,上图中M、N、Q点平衡常数K的大小关系是
,上图中M、N、Q点平衡常数K的大小关系是![]() ,故C正确;
,故C正确;
故答案选AC;
![]() 根据“三段式”计算可得:
根据“三段式”计算可得:
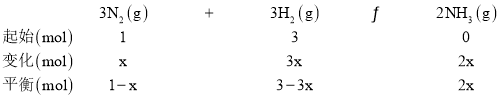
据题意M点时:![]() ,则
,则![]() ,
,
则氢气的转化率为: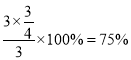 ,
,
故答案为:![]() ;
;
![]() 氨的物质的量为3mol,吸收标准状况下
氨的物质的量为3mol,吸收标准状况下![]() 时.N原子3mol,S原子2mol,据原子守恒,在
时.N原子3mol,S原子2mol,据原子守恒,在![]() 中,其原子个数比N:
中,其原子个数比N:![]() :1,在中,
:1,在中,![]() ,其原子个数比N:
,其原子个数比N:![]() :1,所以,生成物有
:1,所以,生成物有![]() 和
和![]() ,
,
故答案为:![]() 和
和![]() ;
;
![]() 据电荷守恒有:
据电荷守恒有:![]() ,溶液显中性,则,
,溶液显中性,则,![]() ,
,
故答案选:ab;
![]() 氨气是碱性气体,所以电解液最好选择碱性的,
氨气是碱性气体,所以电解液最好选择碱性的,
故答案为:碱性;
![]() 空气中的
空气中的![]() 能和氨水反应,所以,滤去的气体是
能和氨水反应,所以,滤去的气体是![]() ,
,
故答案为:![]() ;
;
![]() 正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:
正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:![]() ,
,
故答案为:![]() .
.


科目:高中化学 来源: 题型:
【题目】下列不符合节能减排要求的是( )
A.将煤块粉碎提高燃料的燃烧效率
B.在汽车上安装汽车尾气催化转化装置,可使汽车尾气中的![]() 和
和![]() 发生反应:
发生反应:![]()
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NA的叙述正确的是( )
A.将22.4LCl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA
B.1molAlCl3在熔融状态时含有的离子总数为4NA
C.1molNa2O2与足量CO2充分反应后转移电子数为2NA
D.一定条件下,28g的乙烯和环己烷混合气体中所含原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中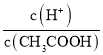 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
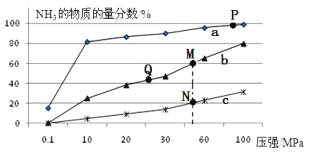
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
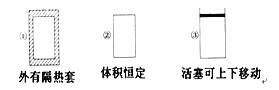
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )
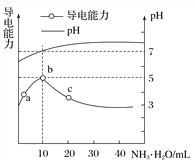
A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com