
����Ŀ������ʵ�鷽������Na2CO3��NaHCO3���ְ�ɫ��ĩ�����ܴﵽԤ��Ŀ�ĵ���(����)
A. �ֱ�������İ�ɫ��ĩ�мӵ��������Ũ�ȵ�ϡ���ᣬ�Ƚ���������Ŀ���
B. �ֱ�������İ�ɫ��ĩ�мӵ����������ˮ���ȽϹ����ܽ����Ķ���
C. �ֱ����İ�ɫ��ĩ�����Һ��Ȼ��������ʯ��ˮ���Ƚ��Ƿ��г�������
D. �ֱ����İ�ɫ��ĩ����ͼװ�ý���ʵ�飬�Ƚϳ���ʯ��ˮ�Ƿ�����
���𰸡�C
�����������������A��̼���ƺ����ᷴӦ������̼�����ƣ�̼�������ٺ����ᷴӦ���ɶ�����̼��
B����ͬ�¶��£�̼�����Ƶ��ܽ��С��̼���ƣ�
C��̼�����ƺ�̼���ƶ����������Ʒ�Ӧ���ɰ�ɫ������
D��̼���ƽ��ȶ������Ȳ��ֽ⣬̼�����Ʋ��ȶ��������ֽ⣮
�⣺A���ֱ�������İ�ɫ��ĩ�мӵ�����������ʵ���Ũ�ȵ�ϡ���ᣬ̼���������������ᷴӦ���ɶ�����̼��̼���ƺ����ᷴӦ������̼�����ƣ�̼�������ٺ����ᷴӦ���ɶ�����̼���������ɶ�����̼���ʲ�ͬ���ܴﵽʵ��Ŀ�ģ���A��ѡ��
B����ͬ�¶��£�̼�����Ƶ��ܽ��С��̼���ƣ����Էֱ�������İ�ɫ��ĩ�мӵ����������ˮ���ȽϹ����ܽ����Ķ����������ܴﵽʵ��Ŀ�ģ���B��ѡ��
C��̼�����ƺ�̼���ƶ����������Ʒ�Ӧ���ɰ�ɫ��������Ӧ������ͬ�����������Բ��ܴﵽʵ��Ŀ�ģ���Cѡ��
D��̼���Ʊ�̼�������ȶ�������ʱ��̼���Ʋ��ֽ⣬̼�����Ʒֽ����ɶ�����̼���ó���ʯ��ˮ�����Ƿ����ɶ�����̼�������ܴﵽʵ��Ŀ�ģ���D��ѡ��
��ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊ���ֶ���������Ԫ�صIJ�������(��֪���ԭ�Ӱ뾶Ϊ0.89��10��10m)��
Ԫ�ش��� | X | Y | Z | M | R | J | Q | T |
ԭ�Ӱ뾶/10��10m | 0.74 | 0.75 | 0.99 | 1.86 | 1.43 | 1.10 | ||
��Ҫ���ϼ� | ��2 | +5����3 | +4����4 | +7����1 | +1 | +3 | +5����3 | |
���� | ԭ�Ӻ��������� | ���ǽ����������� | ������������ |
(1)Ԫ��M��Ԫ�����ڱ��е�λ��Ϊ_________________________��
(2)д��X��Y��J����Ԫ���γɵĻ��������ʽ_________���õ���ʽ��ʾXԪ����ZԪ���γɻ�����Ĺ��̣�_______________________��
(3)д��Y��Q����Ԫ���γɵĻ�������J������������ˮ���ﷴӦ�����ӷ���ʽ_____��
(4)R��T��ȣ��ǽ����Խ�ǿ����____(��Ԫ�ط��ű�ʾ)��������ʵ��֤����һ���۵���_______������ĸ����
A��������T�ĵ��ʳʹ�̬��R�ĵ��ʳ���̬
B��R���⻯���T���⻯���ȶ�
C��R���⻯��ˮ��Һ���Ա�T���������Ӧˮ��������ǿ
D��R��T�γɵĻ�������T������
(5)J��Q��ȣ������Խ�ǿ����____(��Ԫ�ط��ű�ʾ)����֤����һ���۵�������______��
(6)���ݱ��������Ʋ⣬M��ԭ�Ӱ뾶����С��Χ�� ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ˮ��Һ��pH��4��ƻ������Һ��pH��5��������ˮ��Һ��ƻ������Һ��c��OH����֮��Ϊ�� ��
A.10��1
B.1��10
C.2��1
D.4��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ����(CuSO4��xH2O)��һ����;�㷺���Լ���ijС����̽������ͭ��������ʡ�
ʵ��I:̽������ͭ�������ԡ�
ȡ��������ͭ��Һ���Թ��У�����(NH4)2SO3��Һ����������M�����ˡ�ϴ�ӣ��õ�����M��Ϊ��̽��M����ɣ���������ʵ��:
�ٽ�һ����ͬ��M�ֳ����ݡ�
����һ�ݹ����м���ϡ���ᣬ�����д̼�����ζ������(X)����Һ�����ɫ���к�ɫ����������������ͨ��Ʒ����Һ�У�Ʒ����Һ��ɫ��
������һ�ݹ����м���Ũ�ռ���Һ�����ȣ���������(Y)����������ʹʪ��ĺ�ɫʯ����ֽ�������ش���������:
��1��Y�ĵ���ʽΪ_____________________��
��2�����ⶨM�������ӡ������Ӹ���֮��Ϊ2:1��M�Ļ�ѧʽΪ__________��
ʵ��II:̽������ͭ��������ȶ��ԡ�
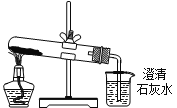
ȡ��������ͭ�������ʵ�飬װ����ͼ��ʾ��

��֪����ʵ������Ϊ:A����ɫ������ɰ�ɫ��ĩ������ɺ�ɫ��ĩ��B�в�����ɫ������D����Һ��ɺ�ɫ��
��3�������Ʋ�����ͭ����ķֽ������_________________________��
��4��B��Cװ�õ�λ�ò��ܻ�����ԭ����_______________________________________��
��5��D�еķ�Ӧ���������У�д����һ����Ӧ�����ӷ���ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ(D2O)����Ҫ�ĺ˹�ҵԭ�ϣ�����˵���������( )
A.�(D)ԭ�Ӻ����� 1 ������
B.1H�� D ��Ϊͬλ��
C.H2O �� D2O ��Ϊͬ��������
D.1H218O��D216O����Է���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ������������ֵ������������ȷ���ǣ� ��
A.��״���£�33.6L�������к��з�ԭ�ӵ���ĿΪ1.5NA
B.3mol����������ˮ������ַ�Ӧ��ת��8NA������
C.50mL18.4molL��1Ũ����������ͭ�ȷ�Ӧ������SO2���ӵ���ĿΪ0.46NA
D.ij�ܱ�����ʢ��0.1molN2��0.3molH2 �� ��һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵����ȷ����( )
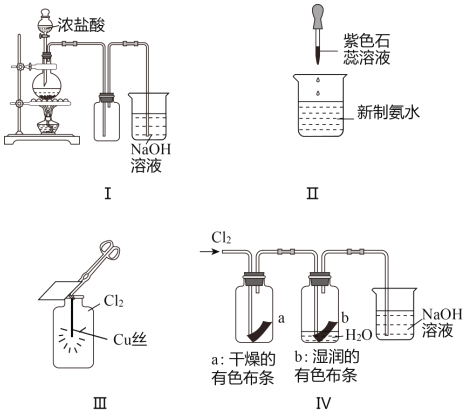
A. ͼ��:��MnO2����,��Ũ�����ȫ�������� B. ͼ��:֤��������ˮ��������
C. ͼ��:�������ػ�ɫ���� D. ͼ��:ʪ�����ɫ������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=1��ij��ҺX�н�����NH4+��Al3+��Ba2+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�����ˮ�ĵ��뼰���ӵ�ˮ�⣩��ȡ����Һ��������ʵ�飬ʵ�������ͼ�������й��ƶϲ���ȷ���ǣ�������
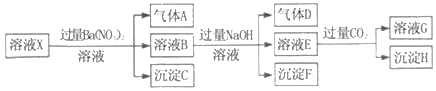
A. ��ҺX��һ������H+��Al3+��NH4+��Fe2+��SO42��
B. ������������ʵ�鲻��ȷ����ҺX���Ƿ���Fe3+��Cl��
C. ����HΪAl��OH��3��BaCO3�Ļ����
D. ����ҺXΪ100mL������������AΪ44.8mL����״��������X��c��Fe2+��=0.06molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д����ȷ����
A. �Ȼ��������ۣ�Fe 3+ ��Fe === 2Fe2+
B. ��������ˮ��2Na �� 2H2O === 2Na+ �� 2OH�� �� H2��
C. ϡ������̼��ƣ�CaCO3 �� 2H�� === Ca2+ �� CO2 �� �� H2O
D. ͭ��Ũ���Cu �� 4H���� 2NO3�� ![]() Cu2����2NO2�� ��2H2O
Cu2����2NO2�� ��2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com