
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质。
实验I:探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量同体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。回答下列问题:
(1)Y的电子式为_____________________。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为__________。
实验II:探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。

己知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有_________________________。
(4)B、C装置的位置不能互换的原因是_______________________________________。
(5)D中的反应分两步进行,写出第一步反应的离子方程式_____________________。
【答案】 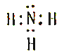 NH4CuSO3 CuO、SO3、SO2、O2、H2O 互换后,SO3溶于品红溶液,BaCl2溶液无法检出SO3 4Fe2++O2+4H+=4Fe3++2H2O
NH4CuSO3 CuO、SO3、SO2、O2、H2O 互换后,SO3溶于品红溶液,BaCl2溶液无法检出SO3 4Fe2++O2+4H+=4Fe3++2H2O
【解析】分析:I、在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成,说明有硫酸铜和单质铜生成;将气体通入品红溶液中,品红溶液褪色,气体是二氧化硫。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝,Y是氨气;
II、A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末,说明逐渐失去结晶水,最终变为氧化铜;B中产生白色沉淀,白色沉淀是硫酸钡,说明有三氧化硫产生;D中溶液变成红色,说明有铁离子生成,因此分解产物中有氧化性气体产生,结合物质的性质、氧化还原反应原理分析判断。
详解:(1)根据以上分析可知Y是碱性气体氨气,氨气是含有共价键的共价化合物,氨气的电子式为![]() 。
。
(2)根据以上分析可知M中的阳离子是铵根离子和亚铜离子,阴离子是亚硫酸根离子。经测定M中阳离子、阴离子个数之比为2:1,因此根据物质显电中性可知M的化学式为NH4CuSO3。
(3)根据以上分析可知分解产物中含有水蒸气、氧化铜、三氧化硫。具有氧化性的气体应该是氧气,氧气只能是氧化产物,则一定还存在还原产物二氧化硫,即硫酸铜晶体的分解产物有CuO、SO3、SO2、O2、H2O。
(4)由于互换后,SO3溶于品红溶液,BaCl2溶液无法检出SO3,所以B、C装置的位置不能互换。
(5)D中的反应分两步进行,第一步是氧气氧化亚铁离子,然后铁离子与KSCN溶液反应,则第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下: 
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8g CO2和3.6g H2O;E的蒸气对氢气的相对密度为30,则E的分子式为 .
(2)A为一取代芳烃,B中含有一个甲基.由B生成C的化学方程式为 .
(3)由B生成D、由C生成D的反应条件分别是、 .
(4)由A生成B、由D生成G的反应类型分别是、 .
(5)F存在于栀子香油中,其结构简式为 .
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有种,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是
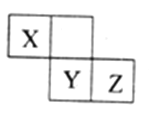
A. 化合物XZ3中各原子均满足8电子的稳定结构
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. 一定条件下,X2与Al反应得到AlX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述正确的是 ( )
A. 钠在空气中燃烧,发出苍白色火焰
B. 钠露置在空气中,表面生成淡黄色的Na2O
C. 钠可以保存在煤油中
D. 钠与水反应的现象可以说明钠的硬度小、熔点低、密度比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
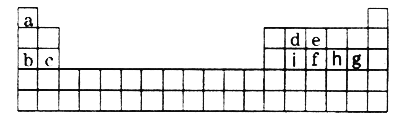
(1)a~i元素中,金属性最强的是________,最高价氧化物对应水化物中,酸性最强的物质是___________。g所在族的元素形成的氢化物中沸点最低的是____________________。
(2)比较b、e、g简单离子半径的大小___________________(用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________、___________________。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______(填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________。
(6)c与a形成的化合物的电子式为___________,用电子式表示a与h形成a2h的过程__________________________________________。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。

下列说法正确的是
A. M点所示溶液c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
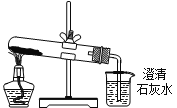
【题目】下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是( )
A. 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B. 分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C. 分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D. 分别将等量的白色粉末用如图装置进行实验,比较澄清石灰水是否变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,成熟的工艺流程如下:干海带 ![]() 海带灰
海带灰 ![]() 悬浊液
悬浊液 ![]() 滤液
滤液 ![]() 碘水
碘水 ![]() I2的CCl4
I2的CCl4
溶液 ![]() I2下列关于海水制碘的说法正确的是( )
I2下列关于海水制碘的说法正确的是( )
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I﹣的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
C.在碘水中加入几滴淀粉溶液,溶液出现蓝色沉淀
D.碘水加入CCl4得到I2的CCl4溶液,该操作为萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组用如图装置制取Cl2 , 证明产生的气体中含有HCl. 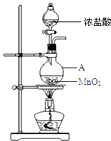
(1)仪器A的名称为;A中反应的离子方程式为;
(2)甲同学将A中产生的气体通入如表溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
(4)已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04molL﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10molL﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL﹣1 AgNO3溶液的体积应大于mL(用含V的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com