
����Ŀ������a��i 9�ֶ�����Ԫ�أ�������ͬ�ڱ��е�λ�����£���ݴ˻ش���������:(���þ����Ԫ�ط��ż���ѧ��������)
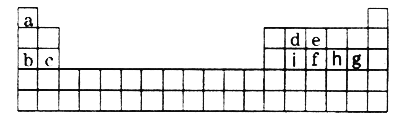
��1��a��iԪ���У���������ǿ����________������������Ӧˮ�����У�������ǿ��������___________��g�������Ԫ���γɵ��⻯���зе���͵���____________________��
��2���Ƚ�b��e��g�����Ӱ뾶�Ĵ�С___________________(�����ӷ�������)��
��3��д����a��i 9��Ԫ���е�ijЩԪ���γɣ�������ԭ�Ӷ����������Ϊ8���ӽṹ���������ֻ�����Ļ�ѧʽ__________________��___________________��
��4����һ����ѧ��Ӧ����ʽ��ʾd�ķǽ�����ǿ��i_______________________________��
��5�����������ڱ���λ�������Ԫ��������������������������ڱ��е�һ��������Ѱ���µ����ʡ����������ڱ�������ͷǽ����Ľ��紦�ҵ��˰뵼����ϡ�
�����е����У��������뵼����ϵ�������______(�����)��
A.Si B.Ge C.S
����(As)��e��ͬ��Ԫ�أ��ϱ�e��2�����Ӳ㣬���һ�ֺ��غ���42�����ӣ��ú��صķ���_________����(Ga)��Asͬ���ڣ��������3�����ӣ�Ga��As�����γ�һ�����ͻ�����뵼����ϣ������ܸ���Խ���������ͻ����ﻯѧʽΪ____________________��
��6��c��a�γɵĻ�����ĵ���ʽΪ___________���õ���ʽ��ʾa��h�γ�a2h�Ĺ���__________________________________________��
��7���������ڱ��Խ��߷�����Be��Al���ʼ��������������ơ���д��Be������������Һ��Ӧ�����ӷ���ʽ_________________________________��
���𰸡� Na HClO4 HCl Cl->N3->Na+ CCl4 PCl3 CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3 C 7533As GaAs ![]()
![]() Be+2OH-=BeO22-+H2��
Be+2OH-=BeO22-+H2��
������������������a��i 9�ֶ�����Ԫ����ͬ�ڱ��е�λ�ÿ�֪�ֱ���H��Na��Mg��C��N��P��Cl��S��Si�����Ԫ�������ɡ��й����ʵ����ʺ�����������
��⣺�������Ϸ�����֪a��i�ֱ���H��Na��Mg��C��N��P��Cl��S��Si����
��1��ͬ�����������ҽ�����������ͬ������ϵ��½���������ǿ����a��iԪ���У���������ǿ����Na���ǽ�����Խǿ����ۺ����������Խǿ��������������Ӧˮ�����У�������ǿ��������HClO4��g����Ԫ�أ��������Ԫ���γɵ��⻯��е���ԭ����������������ߵ���������HF���γ�������е���ߣ���е���͵���HCl��
��2��������Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����b��e��g�����Ӱ뾶�Ĵ�СΪCl->N3->Na+��
��3����a��i 9��Ԫ���е�ijЩԪ���γɣ�������ԭ�Ӷ����������Ϊ8���ӽṹ���������ֻ�����Ļ�ѧʽ��CS2��NCl3��CCl4��PCl3�ȡ�
��4��̼�����Ʊ����ᣬ˵��̼Ԫ�طǽ�����ǿ�ڹ裬��ѧ��Ӧ����ʽΪCO2+H2O+Na2SiO3��H2SiO3��+Na2CO3��
��5����Si��Geλ�ڽ����ͷǽ����Ľ��紦�������뵼����ϣ������������뵼����ϣ���ѡC��
����(As)��e��ͬ��Ԫ�أ��ϱ�e��2�����Ӳ㣬��������7+8+18��33�����һ�ֺ��غ���42�����ӣ���������33+42��75����˸ú��صķ���Ϊ![]() ����(Ga)��Asͬ���ڣ��������3�����ӣ�Ga��As�����γ�һ�����ͻ�����뵼����ϣ����ϼ۷ֱ���+3�ۺͣ�3�ۣ�����������ͻ����ﻯѧʽΪGaAs��
����(Ga)��Asͬ���ڣ��������3�����ӣ�Ga��As�����γ�һ�����ͻ�����뵼����ϣ����ϼ۷ֱ���+3�ۺͣ�3�ۣ�����������ͻ����ﻯѧʽΪGaAs��
��6��c��a�γɵĻ����������ӻ�����MgH2������ʽΪ![]() ��a��h�γɵ�a2h�ǹ��ۻ�����H2S�����õ���ʽ��ʾa��h�γ�a2h�Ĺ���Ϊ
��a��h�γɵ�a2h�ǹ��ۻ�����H2S�����õ���ʽ��ʾa��h�γ�a2h�Ĺ���Ϊ![]() ��
��
��7���������ڱ��Խ��߷�����Be��Al���ʼ��������������ƣ��������������������Һ��Ӧ�ķ���ʽ���ƿɵó�Be������������Һ��Ӧ�����ӷ���ʽΪBe+2OH-��BeO22-+H2����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʯ�����ڳ������Ƭ�������²�����ϩ�����������ʵ�ʵ�飬����������⡣
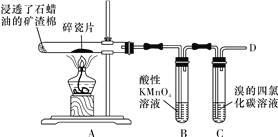
(1)A�����Ƭ��������____________��
(2)��ϩ�ĵ���ʽΪ__________________��
(3)���������У�����ͨ����ϩ�ļӳɷ�Ӧ�õ�����______(����ĸ����)��
A��CH3CH3 B��CH3CHCl2
C��CH3CH2OH D��CH3CH2Br
(4)����ˮ��ʱ��Ϊ������ˮ����������ϩ����ֹˮ�����츯�ã�����������_______��Һ�Ĺ�����������ʢ��ˮ���������С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H10��ϩ�����У�Ҫ����˳���칹�壩�� ��
A.5��
B.6��
C.7��
D.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ˮ��Һ��pH��4��ƻ������Һ��pH��5��������ˮ��Һ��ƻ������Һ��c��OH����֮��Ϊ�� ��
A.10��1
B.1��10
C.2��1
D.4��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ��������������������У��ס��ҡ����о�����ij����ͬ��Ԫ�أ�����֮���������ͼ��ʾת����ϵ����Ӧ���������ֲ�������ȥ���������й����ʵ��ƶϲ���ȷ����
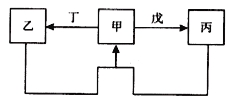
ѡ�� | ���� | ���� |
A | ��ΪS | ����������� |
B | ��ΪAl(OH)3 | ������������������Һ |
C | ��ΪFe | ������������ |
D | ��ΪNa2CO3��Һ | �������CO2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ����(CuSO4��xH2O)��һ����;�㷺���Լ���ijС����̽������ͭ��������ʡ�
ʵ��I:̽������ͭ�������ԡ�
ȡ��������ͭ��Һ���Թ��У�����(NH4)2SO3��Һ����������M�����ˡ�ϴ�ӣ��õ�����M��Ϊ��̽��M����ɣ���������ʵ��:
�ٽ�һ����ͬ��M�ֳ����ݡ�
����һ�ݹ����м���ϡ���ᣬ�����д̼�����ζ������(X)����Һ�����ɫ���к�ɫ����������������ͨ��Ʒ����Һ�У�Ʒ����Һ��ɫ��
������һ�ݹ����м���Ũ�ռ���Һ�����ȣ���������(Y)����������ʹʪ��ĺ�ɫʯ����ֽ�������ش���������:
��1��Y�ĵ���ʽΪ_____________________��
��2�����ⶨM�������ӡ������Ӹ���֮��Ϊ2:1��M�Ļ�ѧʽΪ__________��
ʵ��II:̽������ͭ��������ȶ��ԡ�
ȡ��������ͭ�������ʵ�飬װ����ͼ��ʾ��

��֪����ʵ������Ϊ:A����ɫ������ɰ�ɫ��ĩ������ɺ�ɫ��ĩ��B�в�����ɫ������D����Һ��ɺ�ɫ��
��3�������Ʋ�����ͭ����ķֽ������_________________________��
��4��B��Cװ�õ�λ�ò��ܻ�����ԭ����_______________________________________��
��5��D�еķ�Ӧ���������У�д����һ����Ӧ�����ӷ���ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ(D2O)����Ҫ�ĺ˹�ҵԭ�ϣ�����˵���������( )
A.�(D)ԭ�Ӻ����� 1 ������
B.1H�� D ��Ϊͬλ��
C.H2O �� D2O ��Ϊͬ��������
D.1H218O��D216O����Է���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵����ȷ����( )
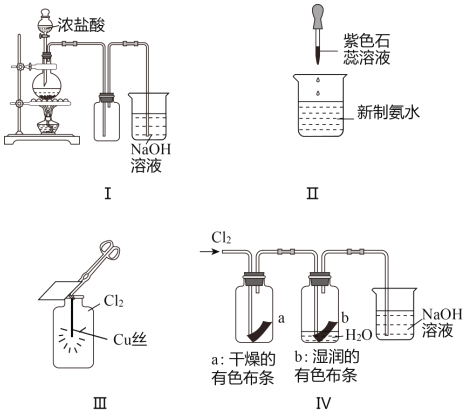
A. ͼ��:��MnO2����,��Ũ�����ȫ�������� B. ͼ��:֤��������ˮ��������
C. ͼ��:�������ػ�ɫ���� D. ͼ��:ʪ�����ɫ������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������������������Ҫ�ɷ�ΪFe3O4��Fe2O3��FeO��SiO2��Ϊԭ���Ʊ��ߵ����ϩ������������죨Fe2O3����
��������������ͼ��![]()
�Իش��������⣺
��1�������ܡ�������Fe3O4������Ӧ�����ӷ�Ӧ����ʽΪ��
��2��ʵ����ʵ�֡�������з���������õIJ��������������������ձ��ȣ��������Ӧѡ���Լ�������Һ��pH������ĸ��ţ�
A��ϡ���� B������������Һ C�����������Һ D����ˮ
��3�����鲽����Ѿ�������ȫ���Լ�����
��4��������ķ�Ӧ�¶�һ���������35�����£���Ŀ������
��5��������з�����Ӧ�Ļ�ѧ��Ӧ����ʽΪ��
��6��������У�FeCO3�ﵽ�����ܽ�ƽ��ʱ���������²����Һ��pHΪ8.5��c��Fe2+��=1��10��6 molL��1 �� ���ж����õ�FeCO3���Ƿ���Fe��OH��2����ǡ�������ͨ������˵����������֪��Ksp[Fe��OH��2]=4.9��10��17����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com