
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
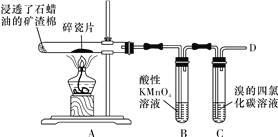
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
【答案】 催化剂 ![]() ACD 高锰酸钾(或KMnO4)
ACD 高锰酸钾(或KMnO4)
【解析】分析:石蜡在碎瓷片的作用下发生裂解生成乙烯,B用于检验乙烯,乙烯可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,C用于检验乙烯发生加成反应的性质,结合乙烯的结构和性质分析解答。
详解:(1)由题意:石蜡油在炽热碎瓷片的作用下产生乙烯,可知其作用主要是催化剂,加快反应速率;
(2)乙烯分子中含有碳碳双键,电子式为![]() ;
;
(3)A.乙烯与氢气发生加成反应生成CH3CH3,A正确;
B.CH3CHCl2不能通过乙烯的加成反应得到,B错误;
C.乙烯与水发生加成反应生成CH3CH2OH,C正确;
D.乙烯与溴化氢发生加成反应生成CH3CH2Br,D正确,答案选ACD。
(4)酸性高锰酸钾溶液能吸收乙烯,因此运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中。


科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
⑧ | ⑨ | ⑩ |
(1)⑥元素在周期表中的位置是第______周期______族;
(2)上表①~⑩十种元素中金属性最强的是______,非金属性最强的是______;(填元素符号)
(3)用电子式写出表中元素④原子与元素⑦原子形成化合物的过程________________;
(4)写出③元素的氢化物与⑩元素的氢化物反应生成盐的电子式__________;
(5)写出③元素的最高价氧化物对应的水化物的稀溶液与过量的元素⑨单质反应的离子方程式_________________________________;
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与元素⑧的最高价氧化物对应的水化物的溶液反应的化学方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。

(1)写出有机物(a)的习惯命名法的名称:________。
(2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。
(3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下: 
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8g CO2和3.6g H2O;E的蒸气对氢气的相对密度为30,则E的分子式为 .
(2)A为一取代芳烃,B中含有一个甲基.由B生成C的化学方程式为 .
(3)由B生成D、由C生成D的反应条件分别是、 .
(4)由A生成B、由D生成G的反应类型分别是、 .
(5)F存在于栀子香油中,其结构简式为 .
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有种,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,2.24 L![]() 中含有碳碳双键数为0.3NA
中含有碳碳双键数为0.3NA
B. 0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
C. 0.1molCH4与0.1molCl2混合充分光照,生成CH3Cl分子数为0.1 NA
D. 0.1molN2和0.3molH2在高温、高压及催化剂下充分反应,产物的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述一定正确的是
A. 2.0gH218O和D2O的混合物中含有质子数为NA
B. 1.0L2.0mol/LNaOH溶液中含有氧原子数为2NA
C. 3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA
D. 标准状况下2.24L的CCl4含有共价键数目为0.4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
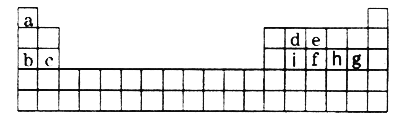
(1)a~i元素中,金属性最强的是________,最高价氧化物对应水化物中,酸性最强的物质是___________。g所在族的元素形成的氢化物中沸点最低的是____________________。
(2)比较b、e、g简单离子半径的大小___________________(用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________、___________________。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______(填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________。
(6)c与a形成的化合物的电子式为___________,用电子式表示a与h形成a2h的过程__________________________________________。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com