
【题目】设NA为阿伏加德罗常数的值,下列叙述一定正确的是
A. 2.0gH218O和D2O的混合物中含有质子数为NA
B. 1.0L2.0mol/LNaOH溶液中含有氧原子数为2NA
C. 3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA
D. 标准状况下2.24L的CCl4含有共价键数目为0.4 NA
【答案】A
【解析】A项,H218O与D2O的相对分子质量均为20,且一个分子所含质子数均为10个,所以2.0gH218O和D2O的混合物为0.1mol,含有0.1NA个分子,则含有质子数为NA,故A正确;B项,NaOH和水中都含有氧原子,所以1.0L2.0mol/LNaOH溶液中含有氧原子数应大于2NA,故B错误;C项,3.4gH2O2的物质的量是0.1mol,参加氧化还原反应时,-1价O可能发生自身氧化还原反应(如2H2O2![]() 2H2O+O2),也可能作氧化剂全部被还原(如2Fe2++H2O2+2H+=2Fe3++2H2O),还可以作还原剂被氧化(如2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O),上述三种情况中,只有-1价O的自身氧化还原反应时,3.4g(0.1mol)H2O2反应转移电子数为0.1NA,而另外两种情况,3.4g(0.1mol)H2O2反应转移电子数为0.2NA,故C错误;D项,1molCCl4含有共价键数目为0.4NA,而标准状况下CCl4不是气体,所以标准状况下2.24LCCl4物质的量应大于1mol,含有共价键数目肯定大于0.4NA,故D错误。
2H2O+O2),也可能作氧化剂全部被还原(如2Fe2++H2O2+2H+=2Fe3++2H2O),还可以作还原剂被氧化(如2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O),上述三种情况中,只有-1价O的自身氧化还原反应时,3.4g(0.1mol)H2O2反应转移电子数为0.1NA,而另外两种情况,3.4g(0.1mol)H2O2反应转移电子数为0.2NA,故C错误;D项,1molCCl4含有共价键数目为0.4NA,而标准状况下CCl4不是气体,所以标准状况下2.24LCCl4物质的量应大于1mol,含有共价键数目肯定大于0.4NA,故D错误。


科目:高中化学 来源: 题型:
【题目】在下列各图曲线中分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是

A. 图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系
B. 图②可以表示ⅡA族元素的最外层电子数
C. 图③可以表示ⅥA族元素氢化物的沸点高低关系
D. 图④可以表示第三周期中的非金属元素对应单质的熔点高低关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
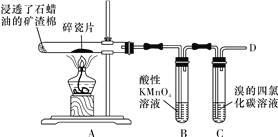
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为八种短周期主族元素的部分性质(已知铍的原子半径为0.89×10-10m):
元素代号 | X | Y | Z | M | R | J | Q | T |
原子半径/10-10m | 0.74 | 0.75 | 0.99 | 1.86 | 1.43 | 1.10 | ||
主要化合价 | -2 | +5、-3 | +4、-4 | +7、-1 | +1 | +3 | +5、-3 | |
其它 | 原子核内无中子 | 无机非金属材料主角 | 有两种氧化物 |
(1)元素M在元素周期表中的位置为_________________________。
(2)写出X、Y、J三种元素形成的化合物电子式_________。用电子式表示X元素与Z元素形成化合物的过程:_______________________。
(3)写出Y与Q两种元素形成的化合物与J的最高价氧化物的水化物反应的离子方程式_____。
(4)R与T相比,非金属性较强的是____(用元素符号表示),下列事实能证明这一结论的是_______(填字母)。
A.常温下T的单质呈固态,R的单质呈气态
B.R的氢化物比T的氢化物稳定
C.R的氢化物水溶液酸性比T的氧化物对应水化物酸性强
D.R与T形成的化合物中T呈正价
(5)J与Q相比,金属性较强的是____(用元素符号表示),能证明这一结论的依据是______。
(6)根据表中数据推测,M的原子半径的最小范围是 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟是一种非金属性极强的元素,它的单质甚至能与稀有气体氙反应生成XeF2、XeF4、XeF6等固体,这些固体都极易与水反应。试回答下列问题:
(1)已知XeF4与H2O反应的化学反应方程式为:6XeF4+12H2O=4Xe↑+3O2↑+2XeO3+24HF,该反应中1molH2O可以还原__________molXeF4。
(2)已知XeF6与H2O发生非氧化还原反应而完全水解(XeF6+3H2O=XeO3+6HF)。现有14.7gXeF6完全水解后,再加入100mL0.600mol·L-1Mn2+的水溶液恰好完全反应,放出的气体干燥后再通过红热的金属铜,气体体积减少20%。
①通过计算可确定Mn2+的氧化产物为_________________离子;
②已知氢氟酸溶液中存在电离平衡,其含氟各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示,图中a 点pH=-lg(4.0×10-4)。

写出氢氟酸的电离平衡常数Ka的数学表达式_________________,将上述(2)中所得溶液稀释到1000mL(不考虑稀释对氢氟酸电离平衡的影响),则稀释后溶液中。H+浓度约为__________ mol·L-1,F-浓度约为__________ mol·L-1。
(3)若先向FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,不呈红色,若再加入足够量FeCl3溶液,呈现红色。请对上述实验现象作出解释____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用ClO2生产NaClO2并进行尾气处理的工艺如下:

(1) 写出“反应Ⅰ”中生成ClO2的化学方程式:______________________________。
(2) “尾气吸收”是为了吸收未反应的ClO2,除减少污染外,还能_________________。
(3) 实验室用下图所示装置模拟“尾气吸收”过程,发现温度较低时吸收效果好,但该反应为放热反应。在不改变吸收液浓度和体积的条件下,欲使反应在0 ℃~5 ℃下进行,实验中可采取的措施有__________、_____________。

(4) 为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取1.000 g上述产品,溶于水配成100.00 mL的溶液。
②取10.00 mL待测液,加入过量的KI溶液,在酸性条件下发生如下反应:ClO+4I-+4H+===2H2O+2I2+Cl-,杂质不与I-反应。
③以______作指示剂,再加入0.2000 mol·L-1 Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为20.00 mL。(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算该样品中NaClO2的纯度_____。
)。计算该样品中NaClO2的纯度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,柠檬水溶液的pH是4,苹果醋溶液的pH是5,则柠檬水溶液与苹果醋溶液的c(OH﹣)之比为( )
A.10:1
B.1:10
C.2:1
D.4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
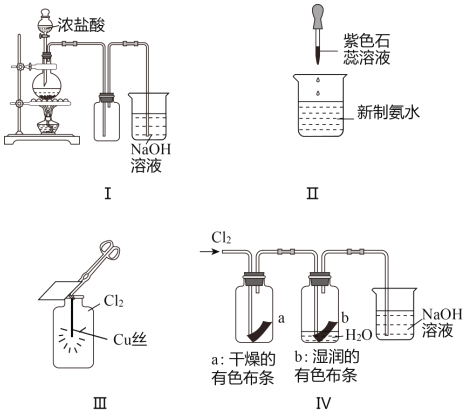
A. 图Ⅰ:若MnO2过量,则浓盐酸可全部消耗完 B. 图Ⅱ:证明新制氯水具有酸性
C. 图Ⅲ:产生了棕黄色的雾 D. 图Ⅳ:湿润的有色布条褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com