
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料﹣﹣﹣﹣﹣铁红(Fe2O3),
具体生产流程如图:![]()
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有、玻璃棒和烧杯等;步骤Ⅳ中应选用试剂调节溶液的pH(填字母编号)
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是;
(5)步骤Ⅵ中发生反应的化学反应方程式为;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10﹣6 molL﹣1 . 试判断所得的FeCO3中是否含有Fe(OH)2(填“是”或“否”),请通过简单计算说明理由(已知:Ksp[Fe(OH)2]=4.9×10﹣17).
【答案】
(1)Fe3O4+8H+=Fe2++2Fe3++4H2O
(2)漏斗;D
(3)KSCN溶液
(4)防止NH4HCO3分解,减少Fe2+的水解
(5)4FeCO3+O2 ![]() ?2Fe2O3+4CO2
?2Fe2O3+4CO2
(6)否;溶液中c(Fe2+)?c(OH﹣)2=1×10﹣6×(1×10﹣5.5)2=1×10﹣17<Ksp[Fe(OH)2]=4.9×10﹣17 , 故无Fe(OH)2沉淀生成
【解析】解:(1.)二氧化硅为酸性氧化物,与硫酸不反应,硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)加入硫酸(酸溶,且温度控制在200~300℃),酸溶过程中四氧化三铁和酸反应生成亚铁离子、铁离子和水,“酸溶”过程中Fe3O4发生反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,所以答案是:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(2.)根据分析可知,步骤Ⅱ为过滤,过滤操作所用的玻璃仪器有漏斗、玻璃棒和烧杯等,步骤Ⅳ中调节pH值的试剂要能与酸反应且不引入新的杂质,所以用氨水较好,故选D,所以答案是:漏斗;D;
(3.)硫氰化钾溶液与铁离子反应,溶液显示红色,可以检验溶液中是否含有铁离子,步骤Ⅲ是将铁离子还原成亚铁离子,检验步骤Ⅲ已经进行完全,即溶液中没有铁离子,可以用KSCN溶液,所以答案是:KSCN溶液;
(4.)步骤Ⅴ是加入碳酸氢铵产生碳酸亚铁溶液,温度过高亚铁离子水解程度增大同进碳酸氢铵容易分解,所以温度一般需控制在35℃以下,所以答案是:防止NH4HCO3分解,减少Fe2+的水解;
(5.)步骤Ⅵ中发生反应为碳酸亚铁在空气中与氧气发生氧化还原反应,可生成氧化铁,反应方程式为4FeCO3+O2 ![]() 2Fe2O3+4CO2 , 所以答案是:4FeCO3+O2
2Fe2O3+4CO2 , 所以答案是:4FeCO3+O2 ![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(6.)室温下测得溶液的pH为8.5,c(OH﹣)= ![]() =1×10﹣5.5 , 由题中数据可知,溶液中c(Fe2+)c(OH﹣)2=1×10﹣6×(1×10﹣5.5)2=1×10﹣17<Ksp[Fe(OH)2]=4.9×10﹣17 , 故无Fe(OH)2沉淀生成,所以答案是:否;溶液中c(Fe2+)c(OH﹣)2=1×10﹣6×(1×10﹣5.5)2=1×10﹣17<Ksp[Fe(OH)2]=4.9×10﹣17 , 故无Fe(OH)2沉淀生成.
=1×10﹣5.5 , 由题中数据可知,溶液中c(Fe2+)c(OH﹣)2=1×10﹣6×(1×10﹣5.5)2=1×10﹣17<Ksp[Fe(OH)2]=4.9×10﹣17 , 故无Fe(OH)2沉淀生成,所以答案是:否;溶液中c(Fe2+)c(OH﹣)2=1×10﹣6×(1×10﹣5.5)2=1×10﹣17<Ksp[Fe(OH)2]=4.9×10﹣17 , 故无Fe(OH)2沉淀生成.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
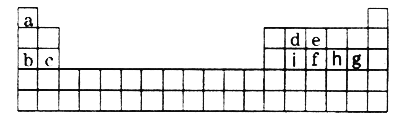
(1)a~i元素中,金属性最强的是________,最高价氧化物对应水化物中,酸性最强的物质是___________。g所在族的元素形成的氢化物中沸点最低的是____________________。
(2)比较b、e、g简单离子半径的大小___________________(用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________、___________________。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______(填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________。
(6)c与a形成的化合物的电子式为___________,用电子式表示a与h形成a2h的过程__________________________________________。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验不合理的是( )
A. 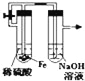 制备并观察氢氧化亚铁
制备并观察氢氧化亚铁
B. 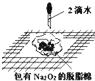 证明过氧化钠与水反应放热
证明过氧化钠与水反应放热
C. 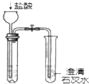 鉴别碳酸钠与亚硫酸钠
鉴别碳酸钠与亚硫酸钠
D. 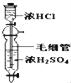 制备少量干燥的氯化氢气体
制备少量干燥的氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
A. 乙烯与溴的四氯化碳溶液反应 B. 苯在一定条件下与氢气反应
C. 甲烷与氯气在光照条件下反应 D. 乙醇在一定条件下生成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是氯碱工业的主要产品之一,常作强氧化剂,可与有机物和无机物进行反应生成多种氯化物。某兴趣小组在实验室中对以下反应进行了探究。回答下列问题:
Ⅰ、三氯化硼(BCl3)的制备,已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。

(1)按气流方向连接各装置的接口,顺序为a→( )→( )→( )→( )→( )→( )→f→g→h。_________
(2)装置D的作用是_____________;实验中若不用装置C,可能产生的危险是____________。
(3)BCl3遇水发生水解观察到大量的白雾,生成两种酸,其反应的化学方程式为:___________。
Ⅱ、SO2与漂粉精溶液的反应
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(4)pH试纸颜色的变化说明漂粉精溶液具有的性质是_____________________________。
(5)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl- 发生反应。该反应的离子方程式为________________________。
(6)用离子方程式解释现象3中黄绿色褪去的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组用如图装置制取Cl2 , 证明产生的气体中含有HCl. 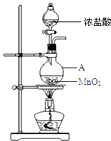
(1)仪器A的名称为;A中反应的离子方程式为;
(2)甲同学将A中产生的气体通入如表溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
(4)已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04molL﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10molL﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL﹣1 AgNO3溶液的体积应大于mL(用含V的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学用下图所示的装置做了有关氨气的性质实验。
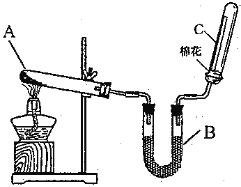
(1)写出A处氯化铵固体与熟石灰共热反应的化学方程式:_____________________________。
(2)B中盛放的是碱石灰,其作用是_____________________________。
(3)氨气极易溶于水,在氨水中滴加酚酞,现象是_________________________________。
(4)检验氨气的方法是___________________________________________________________。
Ⅱ.乙烯是一种重要的有机化工原料。在一定条件下乙烯可发生如下转化:
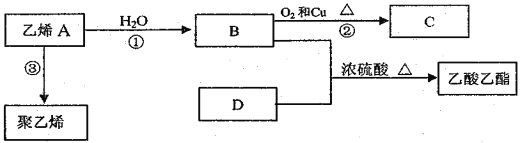
(1)乙烯的结构简式是_______________,D的分子式是_______________。
(2)B中含氧官能团的名称是_____________,③的反应类型是______________。
(3)写出反应②的化学方程式: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘中各放一只盛有足量稀硫酸的烧杯,保持天平平衡。若分别向两烧杯中加入2.3 g 钠和铁,待反应完全后,天平两盘( )
A. 仍平衡 B. 盛钠的一端下沉
C. 盛铁的一端下沉 D. 不能判断天平的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ClO2常温下呈气态,其分子构型与水分子相似,在自然环境中ClO2最终变为Cl﹣ . 下列说法正确的是( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,对人体无任何危害
D.常用Na2SO3在H2SO4存在条件下,还原NaClO3来制ClO2 , 化学方程式为:Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com