
【题目】已知ClO2常温下呈气态,其分子构型与水分子相似,在自然环境中ClO2最终变为Cl﹣ . 下列说法正确的是( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,对人体无任何危害
D.常用Na2SO3在H2SO4存在条件下,还原NaClO3来制ClO2 , 化学方程式为:Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O
【答案】D
【解析】解:A.水分子中价层电子对为 ![]() =4,孤电子对数为
=4,孤电子对数为 ![]() =2,为V形,分子构型与水分子的分子构型相似,ClO2的分子结构呈V型,正负电荷的重心不重合,电荷分布不均匀,属极性分子,故A错误;
=2,为V形,分子构型与水分子的分子构型相似,ClO2的分子结构呈V型,正负电荷的重心不重合,电荷分布不均匀,属极性分子,故A错误;
B.作为消毒剂,具有强氧化性,最终可生成Cl﹣ , 1molClO2可得5mol电子,而1mol氯气得到2mol电子,其消毒效率(以单位体积得电子的数目)是氯气的2.5倍,故B错误;
C.氯气在饮用水中有机物发生氯代,生成对人体有害的含氯有机物,不能广泛应用,应寻找替代品,故C错误;
D.Na2SO3和NaClO3在酸性条件下发生氧化还原反应生成ClO2 , 方程式为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O,故D正确.
故选D.


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料﹣﹣﹣﹣﹣铁红(Fe2O3),
具体生产流程如图:![]()
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有、玻璃棒和烧杯等;步骤Ⅳ中应选用试剂调节溶液的pH(填字母编号)
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是;
(5)步骤Ⅵ中发生反应的化学反应方程式为;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10﹣6 molL﹣1 . 试判断所得的FeCO3中是否含有Fe(OH)2(填“是”或“否”),请通过简单计算说明理由(已知:Ksp[Fe(OH)2]=4.9×10﹣17).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 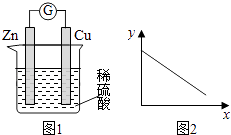
A.铜棒的质量
B.c(Zn2+)
C.c(H+)
D.c(SO42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草,从草中获得化合物和元素,那么,牛和草的化学元素的种类以及相同化学元素的含量分别是( )
A. 种类差异很大,含量大体相同
B. 种类和含量差异都很大
C. 种类和含量都是大体相同
D. 种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图3所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是
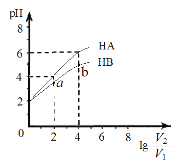
A. a、b两点水的电离程度a小于b
B. HA、HB两种酸溶液pH相同时,c(HA)
C. 曲线上a、b两点![]() 一定相等
一定相等
D. 25℃时,NaA溶液中c(A-)一定大于NaB溶液中c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空。
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.Fe还原水体中NO3﹣的反应原理如图所示. 
①作负极的物质是 .
②正极的电极反应式是 .
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如表:
化学键 | H﹣H | C﹣O | C﹣O | H﹣O | C﹣H |
E/(KJmol﹣1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=kJmol﹣1 . 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要从乙酸的乙醇溶液中回收乙酸,合理的操作组合是( ) ①蒸馏 ②过滤 ③静置分液 ④加足量钠 ⑤加入足量H2SO4 ⑥加入足量NaOH溶液 ⑦加入乙酸与浓H2SO4混合液后加热 ⑧加入浓溴水.
A.⑦③
B.⑧⑤②
C.⑥①⑤②
D.⑥①⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
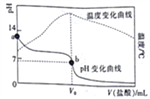
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2 , CO2 , SiO2中的S,C,Si均为sp3杂化
B.SO32﹣ , CO32﹣ , SiO32﹣均为平面三角形
C.H3O+ , NH4+ , [Cu(NH3)4]2+均含有配位键
D.石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com