
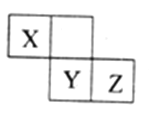
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是
A. 化合物XZ3中各原子均满足8电子的稳定结构
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. 一定条件下,X2与Al反应得到AlX
【答案】B
【解析】分析:根据元素在周期表的相对位置可以得出,X是第二周期元素,Y、Z是第三周期元素。X通过共用三对电子形成X2分子,说明X的最外层有5个电子,属于第ⅤA,即X是氮元素,则Y、Z是S、Cl,结合元素周期律、物质的性质以及题干问题解答。
详解:根据以上分析可知X是N,Y是S,Z是Cl。则
A、在化合物NCl3中N和Cl的化合价分别是+3价和-1价,均满足8电子稳定结构,A正确;
B、只有这三种元素的最高价氧化物的水化物才是强酸,例如H2SO3是弱酸,B错误;
C、氯的非金属性强于硫,氯气能与硫化氢发生置换反应生成氯化氢和单质硫,C正确;
D、氮和铝都是活泼的非金属和金属,二者化合可以生成AlN,D正确。答案是B。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】称取两份铝粉,第一份加足量的浓氢氧化钠溶液,第二份加足量盐酸,如要放出等体积的气体(同温、同压下),两份铝粉的质量之比为
A.1:2B.1:3C.3:2D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为八种短周期主族元素的部分性质(已知铍的原子半径为0.89×10-10m):
元素代号 | X | Y | Z | M | R | J | Q | T |
原子半径/10-10m | 0.74 | 0.75 | 0.99 | 1.86 | 1.43 | 1.10 | ||
主要化合价 | -2 | +5、-3 | +4、-4 | +7、-1 | +1 | +3 | +5、-3 | |
其它 | 原子核内无中子 | 无机非金属材料主角 | 有两种氧化物 |
(1)元素M在元素周期表中的位置为_________________________。
(2)写出X、Y、J三种元素形成的化合物电子式_________。用电子式表示X元素与Z元素形成化合物的过程:_______________________。
(3)写出Y与Q两种元素形成的化合物与J的最高价氧化物的水化物反应的离子方程式_____。
(4)R与T相比,非金属性较强的是____(用元素符号表示),下列事实能证明这一结论的是_______(填字母)。
A.常温下T的单质呈固态,R的单质呈气态
B.R的氢化物比T的氢化物稳定
C.R的氢化物水溶液酸性比T的氧化物对应水化物酸性强
D.R与T形成的化合物中T呈正价
(5)J与Q相比,金属性较强的是____(用元素符号表示),能证明这一结论的依据是______。
(6)根据表中数据推测,M的原子半径的最小范围是 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用ClO2生产NaClO2并进行尾气处理的工艺如下:

(1) 写出“反应Ⅰ”中生成ClO2的化学方程式:______________________________。
(2) “尾气吸收”是为了吸收未反应的ClO2,除减少污染外,还能_________________。
(3) 实验室用下图所示装置模拟“尾气吸收”过程,发现温度较低时吸收效果好,但该反应为放热反应。在不改变吸收液浓度和体积的条件下,欲使反应在0 ℃~5 ℃下进行,实验中可采取的措施有__________、_____________。

(4) 为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取1.000 g上述产品,溶于水配成100.00 mL的溶液。
②取10.00 mL待测液,加入过量的KI溶液,在酸性条件下发生如下反应:ClO+4I-+4H+===2H2O+2I2+Cl-,杂质不与I-反应。
③以______作指示剂,再加入0.2000 mol·L-1 Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为20.00 mL。(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算该样品中NaClO2的纯度_____。
)。计算该样品中NaClO2的纯度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,柠檬水溶液的pH是4,苹果醋溶液的pH是5,则柠檬水溶液与苹果醋溶液的c(OH﹣)之比为( )
A.10:1
B.1:10
C.2:1
D.4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质。
实验I:探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量同体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。回答下列问题:
(1)Y的电子式为_____________________。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为__________。
实验II:探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。

己知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有_________________________。
(4)B、C装置的位置不能互换的原因是_______________________________________。
(5)D中的反应分两步进行,写出第一步反应的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
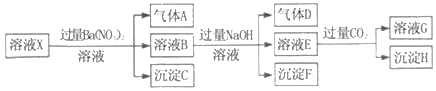
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com