
ЎҫМвДҝЎҝТСЦӘЈәCH3CH2CH2CH3(g)Ј«6.5O2(g)![]() 4CO2(g)Ј«5H2O(l)ЎЎҰӨHЈҪЈӯ2878kJЎӨmolЈӯ1 (CH3)2CHCH3(g)Ј«6.5O2(g)Ўъ 4CO2(g)Ј«5H2O(l)ЎЎҰӨHЈҪЈӯ2869kJЎӨmolЈӯ1
4CO2(g)Ј«5H2O(l)ЎЎҰӨHЈҪЈӯ2878kJЎӨmolЈӯ1 (CH3)2CHCH3(g)Ј«6.5O2(g)Ўъ 4CO2(g)Ј«5H2O(l)ЎЎҰӨHЈҪЈӯ2869kJЎӨmolЈӯ1
ПВБРЛө·ЁХэИ·өДКЗ(ЎЎЎЎ)
AЈ®Хэ¶ЎНй·ЦЧУҙўҙжөДДЬБҝҙуУЪТм¶ЎНй·ЦЧУ
BЈ®Хэ¶ЎНйөДОИ¶ЁРФҙуУЪТм¶ЎНй
CЈ®Тм¶ЎНйЧӘ»ҜОӘХэ¶ЎНйөД№эіМКЗТ»ёц·ЕИИ№эіМ
DЈ®Тм¶ЎНй·ЦЧУЦРөДМјЗвјьұИХэ¶ЎНйөД¶а

| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪҪшРРЦРәНИИөДІв¶ЁЦРЈ¬ПВБРІЩЧчҙнОуөДКЗЈЁ Ј©
A.·ҙУҰЗ°ЛбЎўјоИЬТәөДОВ¶ИТӘПаН¬
B.ІвБҝИЬТәөДОВ¶ИјЖТӘТ»ЦұІеФЪИЬТәЦР
C.ОӘБЛК№·ҙУҰҫщФИҪшРРЈ¬ҝЙТФПтЛбЈЁјоЈ©ЦР·ЦҙОјУИлјоЈЁЛбЈ©
D.ОӘБЛК№·ҙУҰёьНкИ«Ј¬ҝЙТФК№Лб»тјоККөұ№эБҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝIЈ®ОӘБЛСРҫҝ»ҜС§·ҙУҰA+B![]() C+DөДДЬБҝұд»ҜЗйҝцЈ¬ДіН¬С§ЙијЖБЛИзНјЛщКҫЧ°ЦГЎЈөұПтКўУРAөДКФ№ЬЦРөОјУКФјБBКұЈ¬ҝҙөҪUРО№ЬЦРјЧҙҰТәГжПВҪөТТҙҰТәГжЙПЙэЎЈ
C+DөДДЬБҝұд»ҜЗйҝцЈ¬ДіН¬С§ЙијЖБЛИзНјЛщКҫЧ°ЦГЎЈөұПтКўУРAөДКФ№ЬЦРөОјУКФјБBКұЈ¬ҝҙөҪUРО№ЬЦРјЧҙҰТәГжПВҪөТТҙҰТәГжЙПЙэЎЈ
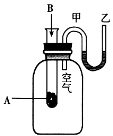
КФ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ёГ·ҙУҰОӘ_______·ҙУҰ(МоЎ°·ЕИИЎұ»тЎ°ОьИИЎұ)ЎЈ
ЈЁ2Ј©AәНBөДЧЬДЬБҝұИCәНDөДЧЬДЬБҝ_______(МоЎ°ёЯЎұ»тЎ°өНЎұ)ЎЈ
ЈЁ3Ј©ОпЦКЦРөД»ҜС§ДЬНЁ№э»ҜС§·ҙУҰЧӘ»ҜіЙ_______КН·ЕіцАҙЎЈ
ЈЁ4Ј©·ҙУҰОп»ҜС§јь¶ПБСОьКХөДДЬБҝ_______(МоЎ°ёЯЎұ»тЎ°өНЎұ)УЪЙъіЙОп»ҜС§јьРОіЙ·ЕіцөДДЬБҝЎЈ
ЈЁ5Ј©РҙіцТ»ёц·ыәПМвЦРМхјюөД»ҜС§·ҪіМКҪЈә_____________________ЎЈ
ўтЈ®Н¬ЛШТмРОМеПа»ҘЧӘ»ҜөД·ҙУҰИИПаөұРЎЈ¬¶шЗТЧӘ»ҜЛЩВКҪПВэЈ¬УРКұ»№әЬІ»НкИ«Ј¬Ів¶Ё·ҙУҰИИәЬА§ДСЎЈПЦФЪҝЙёщҫЭёЗЛ№МбіцөДЎ°І»№Ь»ҜС§№эіМКЗТ»ІҪНкіЙ»т·ЦјёІҪНкіЙЈ¬ХвёцЧЬ№эіМөДИИР§УҰКЗПаН¬өДЎұ№ЫөгАҙјЖЛг·ҙУҰИИЎЈ
ТСЦӘЈә
P4(°ЧБЧЈ¬s)+5O2(g)![]() P4O10(s) ҰӨH=2983.2 kJЎӨmol1 ўЩ
P4O10(s) ҰӨH=2983.2 kJЎӨmol1 ўЩ
P(әмБЧЈ¬s)+ ![]() O2(g)
O2(g)![]()
![]() P4O10(s) ЎчH=738.5 kJЎӨmol1 ўЪ
P4O10(s) ЎчH=738.5 kJЎӨmol1 ўЪ
Фт°ЧБЧЧӘ»ҜОӘәмБЧөДИИ»ҜС§·ҪіМКҪОӘ______________ЎЈПаН¬ЧҙҝцПВЈ¬ДЬБҝЧҙМ¬ҪПөНөДКЗ_______Ј»°ЧБЧөДОИ¶ЁРФұИәмБЧ_______(МоЎ°ёЯЎұ»тЎ°өНЎұ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУРNOЎўCO2ЎўN2O4ИэЦЦЖшМеЈ¬ЛьГЗ·Цұр¶јә¬УР0.5 molСхФӯЧУЈ¬ФтИэЦЦЖшМеөДОпЦКөДБҝЦ®ұИОӘ(ЎЎЎЎ)
A. 1:2:4 B. 1:1:1 C. 4:2:1 D. 1:2:4
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪұкЧјЧҙҝцПВЈ¬ПВБРОпЦКХјМе»эЧоҙуөДКЗЈЁЎЎЈ©ЎЈ
A. 64g H2O B. 6.02ЎБ1023ёцөӘ·ЦЧУ C. 44.8L HCl D. 6gЗвЖш
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜС§РЛИӨРЎЧйУы¶Фә¬ЙЩБҝБтЛбСЗМъәНБтЛбМъөДБтЛбНӯИЬТәҪшРРЧЫәПКөСйЈә
ЈЁ1Ј©іэИҘFe2+әНFe3+ІўЦЖұёCuSO45H2OЈ¬ЗлёщҫЭТФПВБчіМ»ШҙрОКМвЈә
УР№ШЗвСх»ҜОпҝӘКјіБөнәНіБөнНкИ«өДpHИзПВұнЈә
ЗвСх»ҜОп | FeЈЁOHЈ©3 | FeЈЁOHЈ©2 | CuЈЁOHЈ©2 |
ҝӘКјіБөнөДpH | 1.9 | 6.5 | 4.7 |
іБөнНкИ«өДpH | 3.7 | 9.7 | 6.7 |
ўЩКФјБXөД»ҜС§КҪОӘ Ј¬ јУИлКФјБYөчҪЪИЬТәpHөД·¶О§КЗЈ»
ўЪІЩЧчaУГөҪөДІЈБ§ТЗЖчОӘЙХұӯЈ¬ІЈБ§°фәНЈ»ІЩЧчbөДГыіЖОӘЈ»
ЈЁ2Ј©ТСЦӘЈә5Fe2++MnO4©Ғ+8H+=5Fe3++Mn2++4H2OЈ¬УыІв¶Ё»мәПИЬТәЦРөДFe2+өДЕЁ¶ИЈ¬ИЎҙэІвТә20.00mLЈ¬УГЕЁ¶ИОӘ0.01molL©Ғ1өДЛбРФKMnO4ИЬТәөО¶ЁЈ¬ПВБРөО¶Ё·ҪКҪЦРЈ¬ЧоәПАнөДКЗЈЁМоЧЦДёРтәЕЈ¬јРіЦІҝ·ЦТСВФИҘЈ©
ҙпөҪЦХөгКұУГИҘЛбРФKMnO4ИЬТә12.00mLЈ¬ЗлјЖЛгcЈЁFe2+Ј©= Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ°ҙТӘЗуМоҝХ
ЈЁ1Ј©°ҙИзНјөзҪвВИ»ҜДЖөДПЎИЬТәҝЙЦЖөГЖҜ°ЧТәЈ¬РҙіцёГөзҪвіШЦР·ўЙъ·ҙУҰөДЧЬ·ҙУҰ·ҪіМКҪЈәЈ» 
ЈЁ2Ј©Ҫ«ід·ЦөзҪвәуЛщөГИЬТәЦрөОјУИлөҪ·УМӘКФТәЦРЈ¬№ЫІмөҪөДПЦПуКЗ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘјЧҙјөДИјЙХИИКэЦөОӘ726.51kJmol©Ғ1 Ј® ПВБРИИ»ҜС§·ҪіМКҪКйРҙХэИ·өДКЗЈЁ Ј©
A.CH4O+ ![]() O2ЁTCO2+2H2OЎчH=©Ғ726.51 kJ?mol©Ғ1
O2ЁTCO2+2H2OЎчH=©Ғ726.51 kJ?mol©Ғ1
B.CH4OЈЁlЈ©+ ![]() O2ЈЁgЈ©ЁTCO2ЈЁgЈ©+2H2OЈЁgЈ©ЎчH=+726.51 kJ?mol©Ғ1
O2ЈЁgЈ©ЁTCO2ЈЁgЈ©+2H2OЈЁgЈ©ЎчH=+726.51 kJ?mol©Ғ1
C.2CH4OЈЁlЈ©+3O2ЈЁgЈ©ЁT2CO2ЈЁgЈ©+4H2OЈЁlЈ©ЎчH=+1453.12 kJ?mol©Ғ1
D.CH4OЈЁlЈ©+ ![]() O2ЈЁgЈ©ЁTCO2ЈЁgЈ©+2H2OЈЁlЈ©ЎчH=©Ғ726.51 kJ?mol©Ғ1
O2ЈЁgЈ©ЁTCO2ЈЁgЈ©+2H2OЈЁlЈ©ЎчH=©Ғ726.51 kJ?mol©Ғ1
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦУРіЈОВПВpH=2өДСОЛбјЧәНpH=2өДCH3COOHИЬТәТТЈ¬ЗлёщҫЭПВБРІЩЧч»ШҙрОКМвЈә
ЈЁ1Ј©ИЎ10mLөДТТИЬТәЈ¬јУИлЙЩБҝОЮЛ®ҙЧЛбДЖ№ММеЈЁјЩЙијУИл№ММеЗ°әуЈ¬ИЬТәМе»эұЈіЦІ»ұдЈ©Ј¬ҙЧЛбөДөзАлЖҪәвЈЁМоЎ°ПтЧуЎұЎўЎ°ПтУТЎұ»тЎ°І»ЎұЈ©ТЖ¶ҜЈ»іЈОВПВЈ¬БнИЎ10mLөДТТИЬТәЈ¬јУЛ®ПЎКН№эіМЦРЈ¬ПВБРұнҙпКҪөДКэҫЭТ»¶ЁФцҙуөДКЗ Ј®
AЈ®cЈЁH+Ј© BЈ® ![]() CЈ®cЈЁH+Ј©cЈЁOH©ҒЈ© DЈ®
CЈ®cЈЁH+Ј©cЈЁOH©ҒЈ© DЈ® ![]()
ЈЁ2Ј©ИЎөИМе»эөДјЧЎўТТБҪИЬТәЈ¬·ЦұрУГөИЕЁ¶ИөДNaOHПЎИЬТәЦРәНЈ¬ФтПыәДөДNaOHИЬТәөДМе»эҙуРЎ№ШПөОӘЈәVЈЁјЧЈ©VЈЁТТЈ©ЈЁ МоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=ЎұЈ©Ј®
ЈЁ3Ј©ТСЦӘ25ЎжКұЈ¬БҪЦЦЛбөДөзАлЖҪәвіЈКэИзПВЈә
»ҜС§КҪ | CH3COOH | H2CO3 | HClO |
өзАлЖҪәвіЈКэK1 | 1.8ЎБ10©Ғ5 | 4.3ЎБ10©Ғ7 | 3.0ЎБ10©Ғ8 |
K2 | ©Ғ©Ғ | 5.6ЎБ10©Ғ11 | ©Ғ©Ғ |
ПВБРЛДЦЦАлЧУЛ®ҪвіМ¶ИЧоҙуөДКЗ Ј®
A.HCO3©Ғ
B.CO32©Ғ
C.ClO©Ғ
D.CH3COO©Ғ
ЈЁ4Ј©іЈОВПВЈ¬ИЎ99mLјЧИЬТәУл1mL1mol/LөДNaOHИЬТә»мәПЈЁәцВФИЬТәМе»эұд»ҜЈ©Ј¬»ЦёҙЦБіЈОВКұЖдpH= Ј®
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com