
【题目】按要求填空
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:; 
(2)将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是 .
科目:高中化学 来源: 题型:
【题目】文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图. 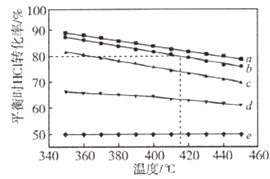
请回答下列问题:
(1)可以判断该反应已经达到化学平衡的是(填字母).
A.密闭容器中总压强不变
B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2)
D.密闭容器中氣气的体积分数不变
(2)d曲线对应的投料比是(填比值,从题干中选择,下同).有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)=制备.
(3)该反应的平衡常数表达式为 .
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为 .
(5)用盐酸作甲醇燃料电池的电解质正在成为热点课题.甲醇可以用一氧化碳与氢气反应生成(催化剂为Cu2O/ZnO).
已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1
CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣182.9kJmol﹣1
O2(g)═CO2(g)+2H2(g)△H=﹣182.9kJmol﹣1
则 CO(g)+2H2(g)═CH3OH(g)△H= .
若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( ) 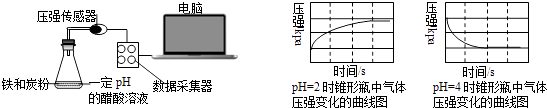
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l) ΔH=-2878kJ·mol-1 (CH3)2CHCH3(g)+6.5O2(g)→ 4CO2(g)+5H2O(l) ΔH=-2869kJ·mol-1
4CO2(g)+5H2O(l) ΔH=-2878kJ·mol-1 (CH3)2CHCH3(g)+6.5O2(g)→ 4CO2(g)+5H2O(l) ΔH=-2869kJ·mol-1
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物种类繁多,性质也各不相同.
(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJmol﹣1 , E2=376.2kJmol﹣1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1(填“增大”、“减小”或“不变”).该反应的热化学方程式为 . 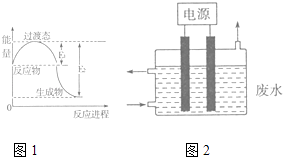
(2)硝基苯甲酸乙酯在OH﹣存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH﹣O2NC6H4COOO﹣+C2H5OH
两种反应物的初始浓度均为0.050molL﹣1 , 某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
回答下列问题:①该反应在330s~530s的平均反应速率为(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 . (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN﹣、Cl﹣废水中的CN﹣ , 控制溶液pH为9~10,阳极产生的ClO﹣将CN﹣氧化为两种无污染的气体,该反应的离子方程式为 , 其中两个电极的材料分别为石墨和铁,则石墨作极,其电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l)Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)Si(s)+2ZnCl2(g)△H2
下列说法正确的是( )
A.Zn(l)=Zn(g)△H= ![]() (△H1﹣△H2)
(△H1﹣△H2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加 Zn(g)的量,△H2变大
D.Zn﹣Cu﹣CuSO4溶液构成的原电池中,Cu片质量增加,Zn片质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在101 kPa时,足量H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为______,表示H2燃烧热的热化学方程式为___________________ 。
(2)1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为________,表示其中和热的热化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列描述合理的是( )
①Cu为阳极,Zn为阴极
②Cu极上有气泡产生
③SO42﹣向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→导线→Zn ⑥正极反应式:Cu+2e﹣═Cu2+ . 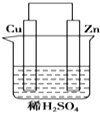
A.①②③
B.②④
C.④⑤⑥
D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com