
【题目】Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l)Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)Si(s)+2ZnCl2(g)△H2
下列说法正确的是( )
A.Zn(l)=Zn(g)△H= ![]() (△H1﹣△H2)
(△H1﹣△H2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加 Zn(g)的量,△H2变大
D.Zn﹣Cu﹣CuSO4溶液构成的原电池中,Cu片质量增加,Zn片质量不变
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+![]() O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列物质占体积最大的是( )。
A. 64g H2O B. 6.02×1023个氮分子 C. 44.8L HCl D. 6g氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:; 
(2)将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物中分离出的化合物 zeylastral 的结构简式如图所示,下列说法不正确的是( ) 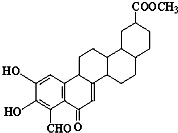
A.该化合物可以发生水解反应
B.该化合物能发生银镜反应
C.该化合物能使酸性KMnO4溶液褪色
D.该化合物共含有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲醇的燃烧热数值为726.51kJmol﹣1 . 下列热化学方程式书写正确的是( )
A.CH4O+ ![]() O2═CO2+2H2O△H=﹣726.51 kJ?mol﹣1
O2═CO2+2H2O△H=﹣726.51 kJ?mol﹣1
B.CH4O(l)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ?mol﹣1
O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ?mol﹣1
C.2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ?mol﹣1
D.CH4O(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.51 kJ?mol﹣1
O2(g)═CO2(g)+2H2O(l)△H=﹣726.51 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池和电解池都能实现能量的置换.回答下列问题:
(1)可将化学能转化为电能是池;
(2)下列反应能设计成原电池的是:
①2FeCl3+Fe═3FeCl2 . Com]
②AlCl3+3NH3H2O═Al(OH)3↓+3NH4Cl
③NaOH+HCl═NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为:
(4)如图装置当闭合电键时,电表显示有电流通过.则Pt极的电极反应式:当甲中产生0.1mol气体时,乙中析出铜的质量应为g. 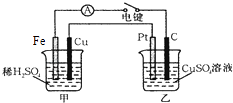
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如图所示。

(1)下列有关生物质能的说法正确的是 。
a.生物质能本质上来源于太阳能
b.纤维素水解获得的产物中含有丰富的生物质能
c.生物质“热裂”获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,可作家庭燃气
(2)由生物质能可获得CO和H2。等物质的量的CO与H2反应时,其原子利用率可达100%,则该反应合成的物质可能是 。
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的区; 溴的价电子排布式为 .
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是 .
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是(填名称).
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II 所示: 
请比较二者酸性强弱:HIO3H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2﹣中心氯原子的杂化类型 , 试写出一个 ClO3﹣的等电子体 .
(6)图1为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3 , NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com