
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的区; 溴的价电子排布式为 .
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是 .
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是(填名称).
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II 所示: 
请比较二者酸性强弱:HIO3H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2﹣中心氯原子的杂化类型 , 试写出一个 ClO3﹣的等电子体 .
(6)图1为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3 , NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为 . 
【答案】
(1)p;4s24p5
(2)氢键
(3)碘
(4)>
(5)sp3;Cl2O或OF2
(6)AD
(7)![]()
【解析】解:(1.)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为:4s24p5 , 故答案为:p;4s24p5;
(2.)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(3.)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:碘;
(4.)H5IO6( 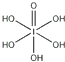 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6 , 故答案为:>;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6 , 故答案为:>;
(5.)ClO2﹣中心氯原子的价层电子对数n=2+ ![]() =4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2﹣互为等电子体的分子为Cl2O、OF2等,故答案为:sp3;Cl2O或OF2;
=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2﹣互为等电子体的分子为Cl2O、OF2等,故答案为:sp3;Cl2O或OF2;
(6.)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I﹣I非极性键,且晶体中分子之间存在范德华力,故D正确;故答案为:AD;
(7.)该晶胞中含有钙离子个数=8× ![]() +6×
+6× ![]() =4,氟离子个数为8,则晶胞体积V=a3 , CaF2密度为=
=4,氟离子个数为8,则晶胞体积V=a3 , CaF2密度为= ![]() =
= ![]() =ρ,则CaF2的相对分子质量M=
=ρ,则CaF2的相对分子质量M= ![]() ,故答案为:
,故答案为: ![]() .
.
(1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;(2)根据氢键分析解答;(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;(5)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;(6)碘为分子晶体,晶胞中占据顶点和面心,以此分析;(7)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量.


科目:高中化学 来源: 题型:
【题目】Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l)Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)Si(s)+2ZnCl2(g)△H2
下列说法正确的是( )
A.Zn(l)=Zn(g)△H= ![]() (△H1﹣△H2)
(△H1﹣△H2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加 Zn(g)的量,△H2变大
D.Zn﹣Cu﹣CuSO4溶液构成的原电池中,Cu片质量增加,Zn片质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列描述合理的是( )
①Cu为阳极,Zn为阴极
②Cu极上有气泡产生
③SO42﹣向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→导线→Zn ⑥正极反应式:Cu+2e﹣═Cu2+ . 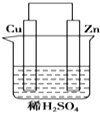
A.①②③
B.②④
C.④⑤⑥
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,C1与C2均为石墨棒,回答下列问题 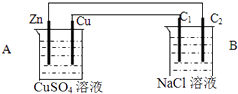
(1)判断装置的名称:A池为B池为
(2)铜极为极,电极反应式为
(3)石墨棒C1为极,电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列四种化合物:
①NO ②N2O4 ③HNO3 ④NH3
(1)氮元素只能作还原剂的是________(填序号,下同)。
(2)可能是HNO2还原产物的是________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式。_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A、B的元素符号依次为、;
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(3)D的核外电子排布式为 , 在形成化合物时它的最高化合价为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组丙为探究Fe3+是否能氧化SO2 , 设计了如图实验装置. 
(1)如上图连接好装置.实验前应进行操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性).
猜想1:;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3﹣氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验.
乙同学认为猜想2正确,则装置C中反应的离子方程式是
(4)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想.请在表格中写出实验步骤以及预期现象和结论.限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、Fe(NO3)3溶液
实验步骤 | 预期现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com