
【题目】A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A、B的元素符号依次为、;
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(3)D的核外电子排布式为 , 在形成化合物时它的最高化合价为 .
【答案】
(1)S;C
(2)V形;直线形;SO2;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子
(3)1s22s22p63s23p63d54s1;+6
【解析】解:A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,外围电子排布为3s2p4 , 故A为S元素;B原子核外的L层电子数是K层的两倍,L层电子数为4,故B为碳元素;C是地壳内含量(质量分数)最高的元素,则C为O元素;D的核电荷数是A与C的核电荷数之和,D的核电荷数为16+8=24,则D为Cr;E在元素周期表的各元素中电负性最大,则E为F元素.
(1.)由上述分析可知,A、B的元素符号依次为S、C,所以答案是:S;C;
(2.)SO2分子中S原子孤电子对数= ![]() =1,价层电子对数为2+1=3,故其立体结构为V形;CO2分子为直线形结构,SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度较大,所以答案是:V形;直线形;SO2;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子;
=1,价层电子对数为2+1=3,故其立体结构为V形;CO2分子为直线形结构,SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度较大,所以答案是:V形;直线形;SO2;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子;
(3.)D为Cr,核外电子数为24,核外电子排布式为1s22s22p63s23p63d54s1 , 在形成化合物时它的最高化合价为+6,所以答案是:1s22s22p63s23p63d54s1;+6.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如图所示。

(1)下列有关生物质能的说法正确的是 。
a.生物质能本质上来源于太阳能
b.纤维素水解获得的产物中含有丰富的生物质能
c.生物质“热裂”获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,可作家庭燃气
(2)由生物质能可获得CO和H2。等物质的量的CO与H2反应时,其原子利用率可达100%,则该反应合成的物质可能是 。
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的区; 溴的价电子排布式为 .
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是 .
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是(填名称).
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II 所示: 
请比较二者酸性强弱:HIO3H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2﹣中心氯原子的杂化类型 , 试写出一个 ClO3﹣的等电子体 .
(6)图1为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3 , NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目: 。
(4)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如下: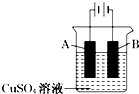
①A电极对应的金属是(写元素名称),B电极的电极反应式是;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图. 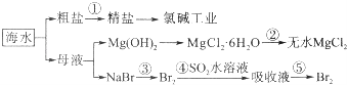
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣等离子.
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的 .
(2)除去粗盐溶液中的杂质(Mg2+、SO42﹣、Ca2+),加入药品的顺序可以为(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl26H2O制得无水MgCl2 , 应如何操作 .
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程.采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为
(5)从第③步到第④步的目的是 . 采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收.主要反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 | 正确 |
B | 向碳酸镁溶液中加入足量稀盐酸: | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)△H<0,在一定条件下达到平衡,测得c(SO3)=0.040mol/L.
(1)该条件下反应的平衡常数K的数值为 , 如升高温度,则K值(填“增大”、“减小”或“不变”).
(2)在其他条件不变时
①若增大O2的浓度,则SO2的转化率(填“增大”或“减小”);
②若升高温度,则平衡(填字母代号);
A.不移动 B.向正反应方向移动 C.向逆反应方向移动
③欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 . (填字母代号)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.使用催化剂V2O5 D.降低反应的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
(已知Ksp[Fe(OH)3]=3.8×10﹣38; Ksp[Cu(OH)2]=2×10﹣20;Ksp(ZnS)=1.6×10﹣24)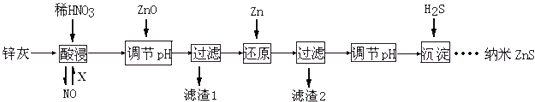
下列说法不正确的是( )
A.酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO3﹣=3Fe3++NO↑+5H2O
B.将酸浸的尾气循环利用,加入的X气体可以是O2
C.滤渣2中的成分和Zn和Fe
D.当溶液中Zn2+浓度为小于1.0×10﹣5molL﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.6×10﹣19molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com