
【题目】下列物质属于氧化物,且溶于水后能使酚酞试液变红的是 ( )
A.氧化铁B.氧化钙C.干冰D.熟石灰
 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,下列物质占体积最大的是( )。
A. 64g H2O B. 6.02×1023个氮分子 C. 44.8L HCl D. 6g氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池和电解池都能实现能量的置换.回答下列问题:
(1)可将化学能转化为电能是池;
(2)下列反应能设计成原电池的是:
①2FeCl3+Fe═3FeCl2 . Com]
②AlCl3+3NH3H2O═Al(OH)3↓+3NH4Cl
③NaOH+HCl═NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为:
(4)如图装置当闭合电键时,电表显示有电流通过.则Pt极的电极反应式:当甲中产生0.1mol气体时,乙中析出铜的质量应为g. 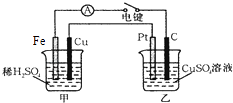
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如图所示。

(1)下列有关生物质能的说法正确的是 。
a.生物质能本质上来源于太阳能
b.纤维素水解获得的产物中含有丰富的生物质能
c.生物质“热裂”获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,可作家庭燃气
(2)由生物质能可获得CO和H2。等物质的量的CO与H2反应时,其原子利用率可达100%,则该反应合成的物质可能是 。
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),醋酸的电离平衡(填“向左”、“向右”或“不”)移动;常温下,另取10mL的乙溶液,加水稀释过程中,下列表达式的数据一定增大的是 .
A.c(H+) B. ![]() C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D. ![]()
(2)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)V(乙)( 填“>”、“<”或“=”).
(3)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×10﹣5 | 4.3×10﹣7 | 3.0×10﹣8 |
K2 | ﹣﹣ | 5.6×10﹣11 | ﹣﹣ |
下列四种离子水解程度最大的是 .
A.HCO3﹣
B.CO32﹣
C.ClO﹣
D.CH3COO﹣
(4)常温下,取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题.
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 .
(2)装置2中的石墨是极(填“正”或“负”)
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为极;铁电极的电极反应
②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的区; 溴的价电子排布式为 .
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是 .
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是(填名称).
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II 所示: 
请比较二者酸性强弱:HIO3H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2﹣中心氯原子的杂化类型 , 试写出一个 ClO3﹣的等电子体 .
(6)图1为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3 , NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 | 正确 |
B | 向碳酸镁溶液中加入足量稀盐酸: | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com