
����Ŀ��ԭ��غ͵��ض���ʵ���������û����ش��������⣺
��1���ɽ���ѧ��ת��Ϊ�������أ�
��2�����з�Ӧ����Ƴ�ԭ��ص��ǣ�
��2FeCl3+Fe�T3FeCl2 �� Com]
��AlCl3+3NH3H2O�TAl��OH��3��+3NH4Cl
��NaOH+HCl�TNaC1+H2O
��3����FeCl3��Һ��ʴӡˢ��·ͭ������ӷ���ʽΪ��
��4����ͼװ�õ��պϵ��ʱ�������ʾ�е���ͨ������Pt���ĵ缫��Ӧʽ�������в���0.1mol����ʱ����������ͭ������ӦΪg�� 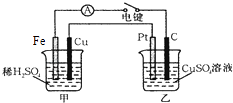
���𰸡�
��1����
��2����
��3��2Fe3++Cu=Cu2++2Fe2+
��4��2H2O��4e��=O2��+4H+��6.4
���������⣺��1�����Է��ķ���������ԭ��Ӧ���ܹ���ԭ��أ�ԭ����л�ѧ��ת��Ϊ���ܣ�����Fe��Cu��ϡ���ṹ��ԭ��أ����׳ؿɽ���ѧ��ת��Ϊ���ܣ�
���Դ��ǣ��ף�
��2.�����Է��ķ���������ԭ��Ӧ����Ƴ�ԭ��أ�
��2FeCl3+Fe�T3FeCl2�������Է��ķ���������ԭ��Ӧ������Ƴ�ԭ��أ�����ȷ��
��AlCl3+3NH3H2O�TAl��OH��3��+3NH4Cl�����ڸ��ֽⷴӦ������������ԭ��Ӧ��������Ƴ�ԭ��أ��ʴ���
��NaOH+HCl�TNaC1+H2O�����ڸ��ֽⷴӦ������������ԭ��Ӧ��������Ƴ�ԭ��أ��ʴ���
���Դ��ǣ��٣�
��3.��FeCl3��Һ��Cu��Ӧ�����Ȼ��������Ȼ�ͭ���䷴Ӧ�����ӷ���ʽΪ��2Fe3++Cu=Cu2++2Fe2+��
���Դ��ǣ�2Fe3++Cu=Cu2++2Fe2+����4������FeΪ������CuΪ������Pt�缫Ϊ����������������������ʧ����������������缫����ʽΪ��2H2O��4e��=O2��+4H+��
����Cu�缫�������ӵõ��������������缫����ʽΪ��2H++2e��=H2��������0.1mol����ʱ��ת�Ƶ���Ϊ0.2mol������C��ͭ���ӵõ�������Cu����缫��ӦΪCu2++2e��=Cu��ת��0.2mol����ʱ����0.1molCu������Cu������Ϊ64g/mol��0.1mol=6.4g��
���Դ��ǣ�2H2O��4e��=O2��+4H+��6.4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ա��������ͼ��ʾװ���������ᣬ����˵����ȷ���ǣ� �� 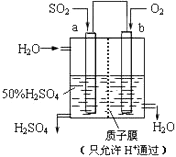
A.a������b����
B.������ӦʽΪ2H2O+SO2��2e��=SO42��+4H+
C.���Ӵ�b����a���ƶ�
D.����������H+��b�缫��ͨ������Ĥ��a�缫���˶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�صĻ���������࣬����Ҳ������ͬ��
��1��ͼ1Ϊһ���¶���1molNO2��g����1molCO��g����Ӧ����NO��g����CO2��g�������е������仯ʾ��ͼ����֪E1=147.5kJmol��1 �� E2=376.2kJmol��1��E1��E2Ϊ��Ӧ�Ļ�ܣ������ڷ�Ӧ��ϵ�м����������Ӧ����������E1�����������С�����䡱�����÷�Ӧ���Ȼ�ѧ����ʽΪ �� 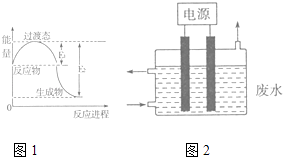
��2������������������OH�����ڵ������·���ˮ�ⷴӦ��
O2NC6H4COOC2H5+OH��O2NC6H4COOO��+C2H5OH
���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050molL��1 �� ij�¶��²��O2NC6H4COOC2H5��ת���ʦ���ʱ��仯���������±���ʾ��
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
��/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
�ش��������⣺�ٸ÷�Ӧ��330s��530s��ƽ����Ӧ����Ϊ��ֻ����ʽ���������㣩
��Ϊ���O2NC6H4COOC2H5��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� �� ��д1�����ɣ�
��3��2015��8��12�����۱�ը����һ�������軯��й¶��������ͼ2��ʾװ�ó�ȥ��CN����Cl����ˮ�е�CN�� �� ������ҺpHΪ9��10������������ClO����CN������Ϊ��������Ⱦ�����壬�÷�Ӧ�����ӷ���ʽΪ �� ���������缫�IJ��Ϸֱ�Ϊʯī��������ʯī��������缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Zn��ԭSiCl4�ķ�Ӧ���£�
SiCl4��g��+2Zn��l��Si��s��+2ZnCl2��g����H1
SiCl4��g��+2Zn��g��Si��s��+2ZnCl2��g����H2
����˵����ȷ���ǣ� ��
A.Zn��l��=Zn��g����H= ![]() ����H1����H2��
����H1����H2��
B.�ù�������̫���ܵ���ǽ���ѧ��ת��Ϊ����
C.���� Zn��g����������H2���
D.Zn��Cu��CuSO4��Һ���ɵ�ԭ����У�CuƬ�������ӣ�ZnƬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ԭ�Ӿ�����ֻ���ڷǼ��Թ��ۼ�
B.ϡ�������γɵľ������ڷ��Ӿ���
C.�ɱ�����ʱ�������ڹ��ۼ��ᷢ������
D.����Ԫ�غͷǽ���Ԫ���γɵĻ�����һ�������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��101 kPaʱ������H2��1 mol O2����ȫȼ������2 molҺ̬ˮ���ų�571.6 kJ��������H2��ȼ����Ϊ______����ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ___________________ ��
(2)1.00 L 1.00 mol��L��1������2.00 L 1.00 mol��L��1 NaOH��Һ��ȫ��Ӧ���ų�114.6 kJ���������÷�Ӧ���к���Ϊ________����ʾ���к��ȵ��Ȼ�ѧ����ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��1�� 2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2(g)����Ϊ1mol SO3(g)�� ��H= -99kJ/mol����ش��������⣺
2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2(g)����Ϊ1mol SO3(g)�� ��H= -99kJ/mol����ش��������⣺
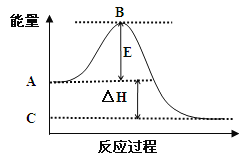
��ͼ��A���ʾ�� �� C���ʾ�� ��
E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ�� (��С����ޡ�)Ӱ�졣
��ͼ����H= kJ/mol��
��2����������������Ӧ����1 molˮ�������ų�241.8 kJ����(25����101 kPa�²��)
��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
����1 molˮ����ת��ΪҺ̬ˮ����45kJ����ӦH2(g) ��1/2O2(g) �� H2O( l )����H = kJ/mol��������ȼ����Ϊ��H = kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������ˮ����ʹ��̪��Һ������ ( )
A.������B.������C.�ɱ�D.��ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���У�3��0����1����2����3����4�ͣ�5���ֻ��ϼۣ��Ծݴ��ж��������ֻ����
��NO ��N2O4 ��HNO3 ��NH3
(1)��Ԫ��ֻ������ԭ������________(����ţ���ͬ)��
(2)������HNO2��ԭ�������________��
(3)��֪CuO���������ԣ��ܹ��Ͱ�����Ӧ�������ֵ��ʣ���д���ڼ���������CuO��NH3��Ӧ�Ļ�ѧ����ʽ��_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com