
| 48.06 |
| 22400 |
| 48.06 |
| 22400 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ||
| A、是氧化还原反应 |
| B、铜是还原剂 |
| C、H2SO4表现了氧化性和酸性 |
| D、反应后铜元素的化合价降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
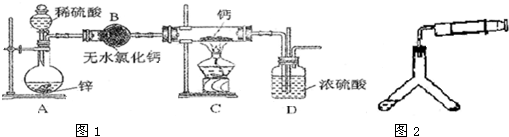
科目:高中化学 来源: 题型:
查看答案和解析>>
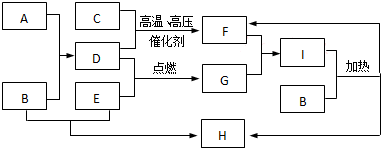
科目:高中化学 来源: 题型:
 分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应:
分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应: b、
b、
 d、
d、
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 化学试剂 |
| 检验酒精中是否有水 | |
| 验证味精是否有食盐 | |
| 区别蔗糖和葡萄糖 | |
| 证明地瓜粉中含有淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硫酸和锌粒制氢气 |
| B、用氯酸钾和二氧化锰加热制氧气 |
| C、用浓盐酸和漂白粉共热制氯气 |
| D、用石灰石和稀盐酸制二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com