
【题目】下列反应中,属于吸热反应的是
A.碳酸钙高温分解B.金属钠与水反应
C.盐酸与氢氧化钠溶液反应D.氢气在氧气在燃烧
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如下图所示。
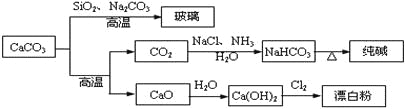
下列说法正确的是( )
A. Cl2和SO2均可以漂白有色物质,且漂白的原理相同
B. 由SiO2+ Na2CO3![]() Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3
Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3
C. 工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3
D. 制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.元素周期表中有7个主族、7个副族
B.稀有气体元素原子的最外层电子数均为8
C.氢是原子半径最小的元素
D.硫元素位于第3周期ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 碳酸氢根离子发生电离:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 用铂电极电解MgCl2溶液:2H2O+2Cl-![]() H2↑+2OH-+Cl2↑
H2↑+2OH-+Cl2↑
C. 将氯气通入NaOH溶液中:Cl2+2OH-==Cl-+ClO-+H2O
D. 将蛋壳浸泡到醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:

回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐是______(填他学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4_____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为______。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸人一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。则K2FeO4酸化时发生反应的离子方程式为_________;K2FeO4作为净水剂的优点除铁无毒外还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在潮湿空气中发生电化腐蚀时,正极发生的主要反应是( )
A. Fe-2e-=Fe2+B. 2H++2e-=H2C. 4OH --4e-=2H2O+O2D. 2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
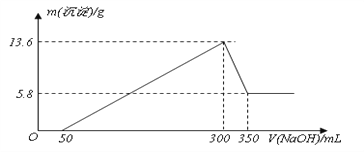
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
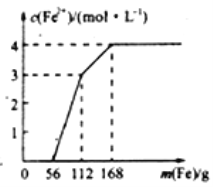
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com