
【题目】某常见微粒X的结构模型可表示为 (
(![]() 代表电子),下列有关X的说法正确的是( )
代表电子),下列有关X的说法正确的是( )
A.微粒X的组成元素不可能是第三周期元素
B.X的组成元素一定是氖元素
C.若X的组成元素原子的核电荷数为8,则X是![]()
D.若X的核内质子数比电子数多,则X最多有2种
科目:高中化学 来源: 题型:
【题目】类推的思想方法在化学学习中应用广泛,下列类推正确的个数有( )
①镁离子、硫离子的最外层电子数均为8,所以离子的最外层电子数均为8
②离子是带电荷的原子,所以带电荷的粒子一定是离子
③原子核由质子和中子构成,所以原子核中都有质子和中子
④化学变化中分子种类一定发生变化,所以分子种类发生改变的变化一定是化学变化
⑤由同种分子构成的物质是纯净物,所以纯净物一定都是由同种分子构成
⑥氧、氯原子的最外层电子数均多于4个,所以非金属原子最外层电子数都多于4个
⑦铁、汞都是由原子直接构成的,所以金属物质都是由原子直接构成的
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为浓H2SO4,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明非金属性S>Si
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,C中先产生白色沉淀后沉淀又溶解
D. 若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测第114号元素具有良好的力学、光学、电学等性质。下列对114号元素的叙述错误的是( )
A.该元素的位于第7周期第Ⅳ![]() 族,是金属元素
族,是金属元素
B.该元素的主要化合价为+2、+4
C.该元素的最高价氧化物有较强的氧化性
D.该元素的原子半径小于同主族其他元素的原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分是CaSO4,含少量的Al2O3、SiO2等杂质)为原料制备Na2SO4、CaBr2·2H2O和NH4Cl等产品的工艺流程如下:
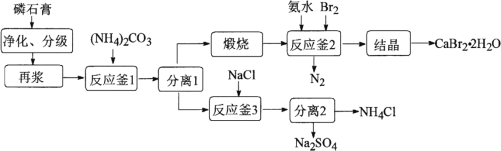
请回答:
(1) 反应釜1中![]() 的浸出率与加料速度、反应温度的关系如下图所示:
的浸出率与加料速度、反应温度的关系如下图所示:
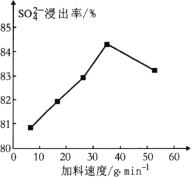
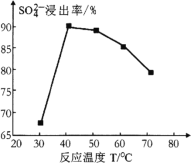
①反应的最佳条件为________。
②其它条件相同时,![]() 浸出率随反应温度先升后降的原因是________。
浸出率随反应温度先升后降的原因是________。
(2) 实验室里模拟上述煅烧操作,下列仪器中有用到的是________。
A 瓷坩埚 B 铁坩埚
C 酒精灯 D 酒精喷灯
(3) 反应釜2中进行的反应是________。
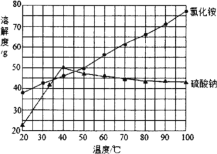
(4) 反应釜3中完成反应后,分离硫酸钠、氯化铵的操作:在90℃左右蒸发浓缩至较多晶体析出→________得到Na2SO4粗品;同时,将热滤液________→得NH4Cl粗品(Na2SO4、NH4Cl的溶解度如图所示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
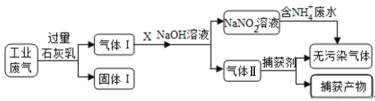
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag,设计的原电池如图所示。
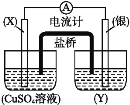
请回答下列问题:
(1)电极X的材料是___;电极X是原电池的___极;
(2)银电极发生的电极反应为___;
(3)今有2H2+O2![]() 2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com