
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
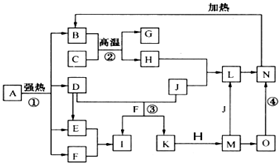 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
| ||
. |
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组解释合理的是( )
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡中学高一上学期期末考试化学试卷(带解析) 题型:单选题
常温下,可用铁或铝制容器盛装冷的浓硫酸,是因为其发生了钝化,这表现浓硫酸的( )
| A.吸水性 | B.脱水性 | C.强氧化性 | D.酸性 |
查看答案和解析>>
科目:高中化学 来源:2015届陕西省高一上学期期末考试化学试卷(解析版) 题型:选择题
常温下,可用铁或铝制容器盛装冷的浓硫酸,是因为其发生了钝化,这表现浓硫酸的( )
A.吸水性 B.脱水性 C.强氧化性 D.酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com