
(12分)接触法制硫酸采用V2O5作催化剂,使用过的催化剂中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,从使用过的V2O5催化剂中回收V2O5的主要步骤是:向使用过的催化剂中加硫酸和Na2SO3浸取还原,过滤得VOSO4溶液;向滤液中加入KClO3氧化,再加入氨水生成沉淀;将沉淀焙烧处理后得V2O5。
(1) V2O5被浸取还原的反应产物之一是VOSO4,该反应的化学方程式为____。
(2) 若生产过程使用的硫酸用量过大,进一步处理时会增加________的用量。氨气常用________检验,现象是________________________。
(3) 若取加入氨水后生成的沉淀(其摩尔质量为598 g·mol-1,且仅含有四种元素)59.8 g充分焙烧,得到固体残留物54.6 g,同时将产生的气体通过足量碱石灰,气体减少了1.8 g,剩余的气体再通入稀硫酸则被完全吸收。通过计算确定沉淀的化学式(写出计算过程)。
(1) Na2SO3+V2O5+2H2SO4===2VOSO4+Na2SO4+2H2O(2分)
(2) 氨水(2分) 红色的石蕊试纸(1分) 能使湿润的红色石蕊试纸变蓝(1分)
(3) n(沉淀)=59.8 g/598 g·mol-1=0.1 mol
n(V)=2n(V2O5)=(54.6 g/182 g·mol-1)×2=0.6 mol(1分)
n(N)=n(NH3)=(59.8 g-54.6 g-1.8 g)/17 g·mol-1=0.2 mol(1分)
n(H2O)=1.8 g/18 g·mol-1=0.1 mol
n(H)=2n(H2O)+3n(NH3)=0.8 mol(1分)
n(O)=n(H2O)+5n(V2O5)=1.6 mol(1分)
沉淀的化学式为V6H8N2O16[或(NH4)2V6O16](2分)
解析试题分析:(1)Na2SO3浸取其被氧化为硫酸盐;(2)加硫酸反应后,加入氨水产生沉淀,若硫酸过多,消耗更多氨水;(3)加入氨水产生的沉淀加热产生气体,根据反应物情况,该气体只能为氨气,分解还产生水,所以应含有V、N、H、O四种元素,
n(沉淀)=59.8 g/598 g·mol-1=0.1 mol
由残留物计算V的量
n(V)=2n(V2O5)=(54.6 g/182 g·mol-1)×2=0.6 mol(1分)
由硫酸增重(氨气)计算N的量
n(N)=n(NH3)=(59.8 g-54.6 g-1.8 g)/17 g·mol-1=0.2 mol(1分)
由碱石灰增重计算水的量,进一步计算H、O元素的量
n(H2O)=1.8 g/18 g·mol-1=0.1 mol
n(H)=2n(H2O)+3n(NH3)=0.8 mol(1分)
n(O)=n(H2O)+5n(V2O5)=1.6 mol(1分)
沉淀的化学式为V6H8N2O16[或(NH4)2V6O16](2分)
考点:考查化学计算有关问题。


科目:高中化学 来源: 题型:填空题
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是 ,还原剂是 ,每生成l molNa2FeO4转移 mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用 ,
。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42- 转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置。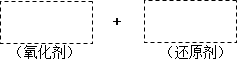
(2)在上图中标明电子转移的方向和数目。
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是____(选填序号)。
a. 盐酸 b. 硫化氢 c. 溴化钠 d. 硫酸亚铁
(4)若向含1mol H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:________________________________,此过程中至少可得到气体_________L(标准状态下)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为 :用化学式表示一种由B、C、E组成的物质 。
(2)B的氢化物比E的氢化物的沸点 (填“高”或“低”),理由是 。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式 。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。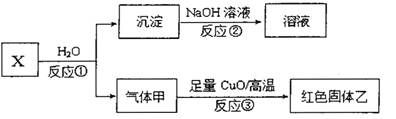
i.写出反应①的化学方程式 。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式 。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是: ,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是: ,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出 。
用改正后的装置进行实验。实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因 ,请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com