
把19.2 g Cu放入足量的稀硝酸中,微热至Cu完全反应。
求:(1)生成的NO在标准状况下的体积。
(2)被还原的硝酸的质量。
(1)4.48L;(2)12.6g。
解析试题分析:根据公式n=m/M计算,19.2g 的Cu的物质的量为0.3mol,
(1)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 44.8L
0.3mol V
V=4.48L,
答:产生的NO在标准状况下的体积为4.48L。
(2)由方程式可以看出,硝酸没有全部被还原,当有3mol铜反应时,有2molHNO3被还原,则0.3mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,质量为:0.2mol×63g/mol=12.6g。
考点:考查根据化学方程式的计算及氧化还原反应。


科目:高中化学 来源: 题型:填空题
近年来,地震、洪水、泥石流等各种自然灾害频发,灾害过后,对环境进行消毒杀菌、获取洁净的饮用水都需要大量消毒剂,开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是 (填序号)。
A.Cl2 B.H2O2 C. O3 D.ClO2
(2)过氧乙酸(CH3COOOH)是一种多用途的新型液体消毒杀菌剂, 它具有CH3COOH 和H2O2的双重性质。下列物质与过氧乙酸混合,不会使过氧乙酸失效的是 (填序号)。
A.FeCl3 B.KMnO4溶液 C.稀盐酸 D.NaHCO3溶液
(3)消毒试剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时,转移的电子数是 。
(4)氯氨(NH2Cl)可作杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理: .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有 个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是 。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目: 。
(3)某厂废水中含1.00×10?3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列反应的化学方程式,并指出氧化剂和还原剂。
(1)锂在空气中燃烧
(2)钾与水反应
(3)镁条在二氧化碳气体中燃烧
(4)曾青得铁则化为铜——湿法炼铜
(5)从赤铁矿中提炼铁——工业冶铁
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(10分)(1)向用氯化铁溶液刻制印刷电路后的废液中,加入足量铁粉,发生反应的离子方程式是 、 。
(2)实验室向某溶液中加入硫氰化钾溶液,无现象,滴加少量氯水,立即变为红色,则原溶液中含有(填离子符号) ,写出滴加氯水时发生反应的离子方程式 。
(3)我们知道,浓硫酸有脱水性、吸水性和氧化性,请写出证明浓硫酸具有氧化性的反应的化学方程式(写一个,多写若有一个错误,本题不得分) 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(12分)接触法制硫酸采用V2O5作催化剂,使用过的催化剂中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,从使用过的V2O5催化剂中回收V2O5的主要步骤是:向使用过的催化剂中加硫酸和Na2SO3浸取还原,过滤得VOSO4溶液;向滤液中加入KClO3氧化,再加入氨水生成沉淀;将沉淀焙烧处理后得V2O5。
(1) V2O5被浸取还原的反应产物之一是VOSO4,该反应的化学方程式为____。
(2) 若生产过程使用的硫酸用量过大,进一步处理时会增加________的用量。氨气常用________检验,现象是________________________。
(3) 若取加入氨水后生成的沉淀(其摩尔质量为598 g·mol-1,且仅含有四种元素)59.8 g充分焙烧,得到固体残留物54.6 g,同时将产生的气体通过足量碱石灰,气体减少了1.8 g,剩余的气体再通入稀硫酸则被完全吸收。通过计算确定沉淀的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【实验目的】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:
( )SO2 +( )MnO4— +( ) =( ) +( )Mn2+ +( )
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验探究】甲同学:甲同学进行了如下图所示A、B两步实验:
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是:
【实验探究】丙同学:丙同学进行了如下图所示实验(部分装置在图中略去):
(3)上图C装置的作用是
(4)证明煤中含有碳元素和硫元素的现象是:
(5)装置C中的高锰酸钾溶液也可以替换为
A.足量I2的淀粉溶液 B.足量饱和NaHCO3溶液 C.足量Na2SO3溶液 D.足量溴水
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操 作 | 现 象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
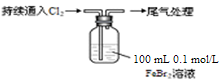 | ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
| 试管 | 操作 | 现象 | 结论 |
| a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | | Cl2的氧化性强于Fe3+ |
| b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )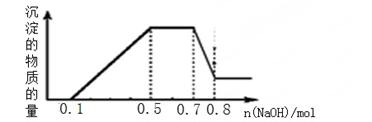
| A.溶液中一定不含CO32?,可能含有SO42?和NO3? |
| B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4]- |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com