
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )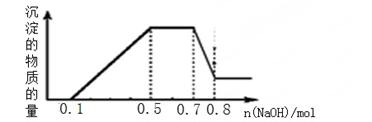
| A.溶液中一定不含CO32?,可能含有SO42?和NO3? |
| B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4]- |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1 |
D
解析试题分析:由①可知溶液中有H+,无CO32-和NO3-,根据溶液电中性,溶液中一定存在SO42-;加入NaOH溶液产生白色沉淀,所以一定不存在Fe3+,根据图象可知:0≤n(NaOH)≤0.1mol时,H++OH-=H2O;0.1mol≤n(NaOH)≤0.5mol时,Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓;0.5mol≤n(NaOH)≤0.7mol时,NH4++OH-=NH3?H2O;0.7mol≤n(NaOH)≤0.8mol时,Al(OH)3 +OH-=AlO2-+H2O,计算可得:n(H+)=0.1mol,n(Al3+)=0.1mol,n(Mg2+)=0.05mol,n(NH4+)=0.2mol,A、根据分析可知:溶液中一定不存在CO32-、Fe3+、NO3-,一定存在H+、NH4+、Mg2+、Al3+、SO42-,故A错误;B、在滴加NaOH溶液物质的量为0.5至0.7mol时,沉淀的物质的量不变,发生的反应为NH4++OH-=NH3?H2O,故B错误;
C、溶液中一定存在的阳离子为H+、NH4+、Mg2+、Al3+,故C错误;D、根据以上计算可知,n(H+)=0.1mol,n(Al3+)=0.1mol,n(Mg2+)=0.05mol,n(NH4+)=0.2mol,所以n(H+):n(NH4+):n(Mg2+)=0.1mol:0.2mol:0.05mol=2:4:1,故D正确;故选D。
考点:考查离子共存、常见离子的检验


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:实验题
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加 | |
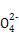 +3Mn
+3Mn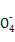 +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为: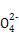 )= ;FeC2O4的质量分数为 (精确到0.01%)。
)= ;FeC2O4的质量分数为 (精确到0.01%)。 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: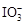 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: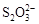 >I-;②KI+I2
>I-;②KI+I2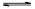 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有 (用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| | 0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol·L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于Na2O2的叙述,正确的是 ( )
| A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1:1 |
| B.Na2O2晶体为离子晶体,且含极性共价键 |
| C.Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 |
| D.Na2O2与盐酸反应,不仅有盐和水生成,同时会放出无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl―、OH―;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
| A.3︰2︰1 | B.2︰3︰1 | C.2︰4︰1 | D.4︰2︰1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol?L-1
②向另一份固体中加入100 mL 4.0 mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol?L-1则产生的气体的体积(标准状况)为 ( )
| A.2.856L | B.2.448L | C.2.688L | D.2.352L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
| A.0.24mol | B.0.21mol | C.0.25mol | D.0.12mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com