
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有 个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是 。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目: 。
(3)某厂废水中含1.00×10?3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 g FeSO4·7H2O。
五.(本题共8分)
(1) 2 (1分) c d (2分) 6e
(2)Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O(3分)
(3)2.78克(2分)
解析试题分析:
(1)氧化还原反应只有Ⅰ,该反应中Cr从+3到+6价,Fe从+2到+3价,O2中O从0到-2价。
(2)该反应中Cr从+6到+3,做氧化剂,那么Fe从+2到+3做还原剂,然后根据缺项配平,可以写出反应方程式。
(3)根据Cr0.5Fe1.5FeO4中,Cr:Fe=0.5:2.5=1:5;故有n(FeSO4·7H2O)=1.00×10-3mol/L×1L×2×5=10×10-3mol,故质量为2.78g。
考点:氧化还原反应概念、氧化还原反应方程式的书写及配平,化学计算。


科目:高中化学 来源: 题型:填空题
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
| A.Na2O2 + 2HCl =" 2NaCl" + H2O2 |
| B.Ag2O + H2O2 =" 2Ag" + O2↑ + H2O |
| C.2H2O2 = 2H2O + O2↑ |
| D.3H2O2 + Cr2(SO4)3 + 10KOH = 2K2CrO4 + 3K2SO4 + 8H2O |

| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下: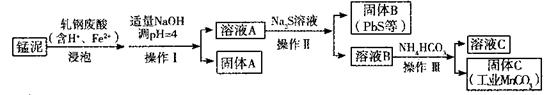
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中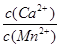 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是 ,还原剂是 ,每生成l molNa2FeO4转移 mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用 ,
。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42- 转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某体系中存在如下反应:
①H2S+4H2O-8e → SO42-+10H+
②2IO3-+12 H++10e → I2+6H2O
(1)反应①中H2S做__________剂,反应②属于___________ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成 g I2。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________。
(4)由上述反应可推知 。
a.氧化性:K2SO4> KIO3 b.酸性:HIO3> H2SO4
c.还原性:H2S > I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加 | |
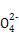 +3Mn
+3Mn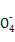 +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为: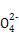 )= ;FeC2O4的质量分数为 (精确到0.01%)。
)= ;FeC2O4的质量分数为 (精确到0.01%)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com