
����Ŀ��������H�Ǻϳ�ҩ������ɳ����������Ҫ�м��壬��ϳ�·����ͼ��
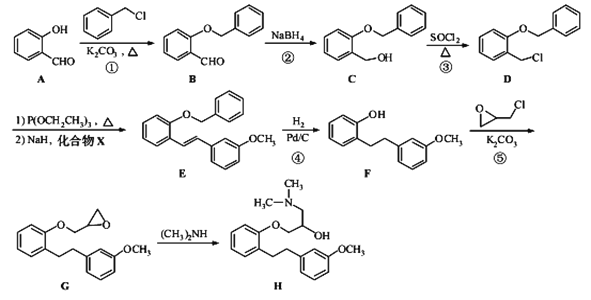
��1��������A�еĺ���������Ϊ___��___(�����������)��
��2����Ӧ�ݵķ�Ӧ������___����Ӧ����ʽ___��
��3��B�ķ���ʽ___��1molB��������������Һ��Ӧ������ܲ���___gAg��
��4������D��±ԭ�����࣬������Լ���___��
��5��д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ��___��
a.�����������������
b.��������7�ֲ�ͬ��ѧ�������⣻
c.������FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ�ܷ����˷�Ӧ��
���𰸡��ǻ� ȩ�� ȡ����Ӧ 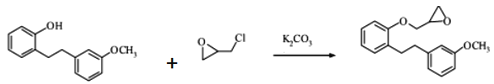 +HCl C14H12O2 216 NaOHˮ��Һ����NaOH����Һ����ϡ���ᡢ��������Һ
+HCl C14H12O2 216 NaOHˮ��Һ����NaOH����Һ����ϡ���ᡢ��������Һ ![]() ����
����![]() ��
��
��������
��1����ͼ��A�Ľṹ��ʽ��֪��������A�еĺ���������Ϊ�ǻ���ȩ����
��2����Ӧ��Ϊ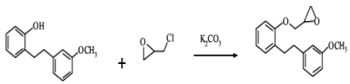 + HCl������ȡ����Ӧ��
+ HCl������ȡ����Ӧ��
��3��B�ķ���ʽΪC14H12O2��B�����к���һ��ȩ����1mol B��������������Һ��Ӧ������2mol��Ag�����Է�Ӧ����ܲ���Ag������Ϊ��2mol��108g/mol=216g��
��4������D��±ԭ��Ϊ��ԭ�ӣ����������ʱ��������Լ���NaOHˮ��Һ����NaOH����Һ����ϡ���ᡢ��������Һ��
��5��ͬʱ����
A�������������������
B����������7�ֲ�ͬ��ѧ�������⣻
C��������FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ�ܷ����˷�Ӧ
�⼸��������B��ͬ���칹��Ľṹ��ʽΪ��![]() ����
����![]() ����
����


 ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Se����һ�ַǽ���Ԫ�ء����������������ϡ��������ҵ����������������Ӫ��Ԫ�غ�ֲ�������Ӫ��Ԫ�صȡ���ش��������⣺
��1�� SeԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ____�����������е�һ�����ܱ�SeԪ�ش�Ĺ���____�֣��Ԫ�س��⣩��
��2����̬SeO3���ӵļ۲���ӶԻ���ģ��Ϊ____ ��SeO42-������Seԭ�ӵ��ӻ���ʽΪ ___ ��
��3����̬SeO2����[SeO3]�����Խ������ӵ�չƽ�ľۺϽṹ��ÿһ�����һ�������ն�Oԭ�ӣ�����ͼ1��ʾ����
��ͼ1��Se-O�������϶̵��� ___������a"����b"������ԭ����______��
��SeO2�۵�Ϊ350������̬SeO2����___���壬���۵�Զ����SO2��-75.5������ԭ���� ____��
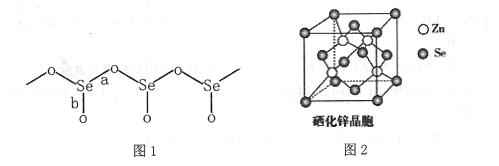
��4������п��ZnSe����һ����Ҫ�İ뵼����ϣ��侧���ṹ����ͼ2��ʾ�����������Ӳ��������������ܶѻ���ʽ��X��������ʵ����ZnSe�ľ�������a=0. 560nm����Se2-�����Ӱ뾶r(Se2-)= ____nm������������3λ��Ч���֣���ͬ��������п������ܶ�Ϊ________ g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯīϩ��ͼ a����һ���ɵ���̼ԭ�ӹ��ɵ�ƽ��ṹ���͵�����ϣ����д���������ϵ��ʯīϩ �в���̼ԭ�ӱ���������ƽ��ṹ�����ı䣬ת��Ϊ����ʯīϩ��ͼb����
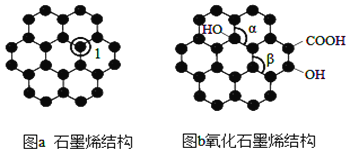
(1)ͼa�У�1��C���ӻ���ʽΪ______��ʯīϩ�к��еĻ�ѧ��������_____����Լ����Ǽ��Լ�����ͼb�м�����____������(���� >������<������=��)��ˮ���ӵĿռ乹����____��
(2)��̬��ԭ�ӵļ۵����Ų�ʽΪ______��
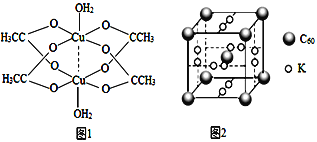
(3)����ͭ�ɺϳɸ��ϲ���ʯīϩ![]() �����Ʊ�ԭ��ΪCuSO4��NH3��H2O�ʹ���ȡ�
�����Ʊ�ԭ��ΪCuSO4��NH3��H2O�ʹ���ȡ�
��д��һ����SO42-��Ϊ�ȵ�����ķ���______��
�ڶ��۴���ͭ�Ľṹʾ��ͼ��ͼ1��ʾ��Cu2+����λ��Ϊ______��
(4)ʯīϩ��ת��Ϊ����ϩ(C60)��C60��K���γ����ͻ�����侧����ͼ2��ʾ�������߳�����Ϊanm���û�������Kԭ�Ӻ�C60���ӵĸ�����Ϊ_____���þ�����ܶ���=_____ g.cm-3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й���������ȷ����
A. ���³�ѹ�£�1 mol�����к��е�������Ϊ2NA
B. l0g46%�Ҵ�ˮ��Һ��������ԭ����Ϊ0.4NA
C. 1 Ll mol/LNa2CO3��Һ�У�����������С��NA
D. Ũ�����ȷֽ�����NO2��N2O4��23g��ת�Ƶ�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڵ�������Ԫ�ؼ��䵥�ʺͻ������У�ԭ�Ӱ뾶��С��Ԫ����________(��Ԫ�ط��Ż�ѧʽ��ʾ����ͬ)����������ǿ�ĵ�����________����ԭ����ǿ�ĵ�����________������������Ӧ��ˮ������������ǿ����________��������ǿ����________���γɵ���������������________��
��2����ij�¶���,���ܱ������н������з�Ӧ:2SO2(��)+O2(��)![]() 2SO3(��)��ʼ:c(SO2)=3mol/L,c(O2)=2mol/L,��ƽ��ʱ,80%��SO2ת��ΪSO3,��ʱc(SO2)=________mol/L,c(O2)=________mol/L,c(SO3)=________mol/L
2SO3(��)��ʼ:c(SO2)=3mol/L,c(O2)=2mol/L,��ƽ��ʱ,80%��SO2ת��ΪSO3,��ʱc(SO2)=________mol/L,c(O2)=________mol/L,c(SO3)=________mol/L
��3��ȼ��11.2L����״�������飬���ɶ�����̼�����ʵ���Ϊ________������ˮ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ե�ؾ��������ŵ��������ص㣬����õ��㷺Ӧ�ã�п���̼��Ե��������������ҺΪ���Һ������ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+H2O��l��![]() Zn��OH��2��s��+Mn2O3��s�� ����˵��������ǣ� ��
Zn��OH��2��s��+Mn2O3��s�� ����˵��������ǣ� ��
A. ��ع���ʱ��пʧȥ����
B. ��������ĵ缫��ӦʽΪ��2MnO2��s��+H2O��1��+2e��=Mn2O3��s��+2OH����aq��
C. ��ع���ʱ������������ͨ�����·����
D. ���·��ÿͨ��0.2mol���ӣ�п�����������ϼ�С6.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£��ݻ�Ϊ2 L���ܱ������У���2 mol L�����3 mol M�����ϣ��������·�Ӧ��2L(g)��3M(g)![]() xQ(g)��3R(g)��10sĩ������2.4 mol R�������Q��Ũ��Ϊ0.4 mol��L��1�����㣺
xQ(g)��3R(g)��10sĩ������2.4 mol R�������Q��Ũ��Ϊ0.4 mol��L��1�����㣺
��1��10 sĩL�����ʵ���Ũ��Ϊ_____________��
��2��ǰ10 s����M��ʾ�Ļ�ѧ��Ӧ����Ϊ_____________��
��3����ѧ����ʽ��xֵΪ_____________��
��4���ں��º����������������м���1 mol��������Ӧ����________(����С������)��
��5���ں��º�ѹ�������������м���1 mol��������Ӧ����________(����С������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��� a(![]() )��b(
)��b(![]() ) ��c(
) ��c(![]() ����˵����ȷ����
����˵����ȷ����
A.a��b ��Ϊͬϵ��
B.C ������̼ԭ�ӿ��ܴ���ͬһƽ��
C.b ��ͬ���칹���к����Ȼ��Ľṹ���� 7 �֣����������칹��
D.a ������ˮ��b ��c ����ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ǧ���طŵ�ʱ��ԭ��ط�Ӧ��PbO2��Pb��2H2SO4===2PbSO4��2H2O������Ǧ���ص�����˵������ȷ���ǣ� ��
A. �ŵ�ʱ��������Ӧʽ��Pb��SO42-��2e��===PbSO4
B. �ŵ�ʱ��صĸ���������Ǧ��
C. ���ʱ������������Ũ�Ȳ��ϱ�С
D. ���ʱ��Ǧ�巢��������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com