
| A、可用纸层析法检验氯化铁溶液中是否混有少量氯化铜 |
| B、为了检验新鲜鸡血中的铁元素,可以在鸡血中加入稀硝酸并加热搅拌后蒸干,得到固体粉末,取少许粉末加入到装有2mL亚铁氰化钾稀溶液的试管中,可以得到蓝色溶液 |
| C、在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液,溶液褪色,说明CaCl2溶液显酸性 |
| D、用干燥且洁净的玻璃棒蘸取少量NaClO溶液,滴到放在表面皿上的pH试纸上测pH |


科目:高中化学 来源: 题型:
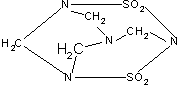 2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂--毒鼠强,导致多人中毒死亡;已知毒鼠强的结构简式如图,有关毒鼠强(化学名:四亚甲基二砜四胺)的下列相关说法正确的是( )
2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂--毒鼠强,导致多人中毒死亡;已知毒鼠强的结构简式如图,有关毒鼠强(化学名:四亚甲基二砜四胺)的下列相关说法正确的是( )| A、毒鼠强属于无机物 |
| B、毒鼠强属于烃 |
| C、毒鼠强分子内含SO2分子因而具有毒性 |
| D、毒鼠强的分子式为C4H8N4S2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+=H2O+CO2↑ |
| B、FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
| C、硫酸铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ |
| D、将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铍是两性氢氧化物 |
| B、B、Si的电负性数值相近 |
| C、BeCl2是离子化合物,Al Cl3是共价化合物 |
| D、Li在N2中燃烧能生成Li3N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱金属单质在空气中燃烧的生成物都是过氧化物 |
| B、少量的碱金属单质都能保存在煤油中 |
| C、HF、HCl、HBr、HI还原性从左到右依次减弱 |
| D、AgCl、AgBr、AgI的颜色由浅到深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | c(CrO
| c(HCrO
| c(Cr2O
| c(H2CrO4) | ||||||
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 | ||||||
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 | ||||||
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 | ||||||
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
A、铬酸第一级电离方程式为H2CrO4═H++HCrO
| ||||
| B、该铬酸溶液的物质的量浓度约为1 mol?L-1 | ||||
C、要得到CrO
| ||||
D、当电离达到平衡时,2v正(HCrO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46 g乙醇中含有的化学键数为7 NA |
| B、1 mol OH- 和1 mol-OH(羟基)中含有的质子数均为 9 NA |
| C、22.4L氯气和足量NaOH溶液反应转移电子数为NA |
| D、0.1 mol?L-1 FeCl3溶液制成胶体,含有Fe(OH)3胶粒数一定小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com