
����Ŀ�������йصζ���˵����ȷ���ǣ� ��
A. ��25mL�ζ��ܽ����к͵ζ�ʱ����ȥ��Һ�����Ϊ21.7mL
B. �ñ���KOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ���Ʊ���Һ�Ĺ���KOH����NaOH���ʣ�����ƫ��
C. ��C1mol/L���Ը��������Һ�ζ�V2mLδ֪Ũ�ȵ�H2C2O4��Һ�����ζ��յ���ȥ���Ը��������Һ���ΪV1mL����H2C2O4��Һ��Ũ��Ϊ![]() mol/L
mol/L
D. ��δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ��ᵼ�²ⶨ���ƫ��
���𰸡�B
��������A���ζ��ܵľ���Ϊ0.01ml����A����B�������Ʊ���Һ�Ĺ���KOH����NaOH���ʣ�ʹKOHŨ��ƫ�ߣ��ζ�δ֪Ũ�ȵ�����ʱ����ʹ���ı�Һ�����ƫС��ʹ��������Ũ��ƫС��C�����Ը��������Һ�ζ�δ֪Ũ�ȵ�H2C2O4��Һ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O n��KMnO4����n��H2C2O4��=2��5����H2C2O4��Һ��Ũ��Ϊ![]() ,��C����D����δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ�ʹ��õ�������Һ���ƫС�����²ⶨ���ƫ�ͣ���D����ѡB��
,��C����D����δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ�ʹ��õ�������Һ���ƫС�����²ⶨ���ƫ�ͣ���D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Na2SO4��Һ����Ba2+��Pb2+��Ca2+���ֽ�������(M2+)������SO42-���Ũ�ȵĶ���ֵp(SO42-)=��lgc(SO42-)��p(M2+)=��lgc(M2+)��ϵ��ͼ��ʾ������˵����ȷ����

A. KSP(CaSO4)<KSP(PbSO4)<KSP(BaSO4)
B. a��ɱ�ʾCaSO4�ı�����Һ����c(Ca2+)=c(SO42-)
C. b��ɱ�ʾPbSO4�IJ�������Һ����c(Pb2+)<c(SO42-)
D. ��Ba2+Ũ��Ϊ10-5mol��L-1�ķ�ˮ�м���CaSO4��ĩ������BaSO4��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ:
2Zn(s)+O2(g)=2ZnO(s) ��H1
4Ag(s)+O2(g)=2Ag2O(S) ��H2
��Zn(s)+Ag2O(s)=2Ag(s)+ZnO(s),��HֵΪ
A. ��H2-��H1 B. ��H2+��H1 C. ![]() (��H1-��H2) D.
(��H1-��H2) D. ![]() (��H2-��H1)
(��H2-��H1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������и���
��1���̬���ʲ��ȶ��������ֽ⣮д���Ȼ�泥�NH4Cl�����ȷ����ֽⷴӦ�Ļ�ѧ����ʽ ��
��2����ϩ��ʹ��ˮ��ɫ������1��2���������飨CH2 Br��CH2 Br����д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���������жϷǽ�����ǿ�����ݵ���
A. ���ʵ��۵㡢�е�ߵ�
B. �ǽ���֮�䷢�����û���Ӧ
C. �ǽ���������������̬�⻯������׳̶�
D. �ǽ���Ԫ�ص�����������ˮ���������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ� ��
A. ��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
B. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
C. ���Թ�A��Ӧ�Ӽ������Ƭ�Է�ֹA�е�Һ�����ʱ��������
D. ��Ӧ���������Թ�b��b��Һ���Ϊ���㣬�ϲ�Ϊ����ζ��ɫ��״Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������У�һ�������·�����ѧ��Ӧ��2NO��g��+2CO��g��N2��g��+2CO2��g����H=��746.4kJmol��1 �� ��ʼ��ӦʱNO��CO��Ϊ4mol��10���Ӻ�ﵽ��ѧƽ�⣬���N2Ϊ1mol�������йط�Ӧ���ʵ�˵���У���ȷ���ǣ�������
A.��Ӧǰ5�����ڣ���NO��ʾ��ƽ����Ӧ����Ϊ0.1molL��1s��1
B.�ﵽƽ��������¶ȣ�����Ӧ���ʽ���С���淴Ӧ���ʽ�����
C.�ﵽƽ���Ӧ���ʵĹ�ϵ�У�v����CO��=2v����N2��
D.��������������䣬�������г���1mol O2 �� �����淴Ӧ���ʶ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1 L pH=10��NaOH��Һ�г���ͨ��CO2 �� ͨ��CO2�������V������Һ��ˮ�������c��OH�����Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ������� 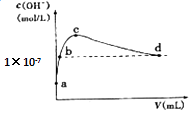
A.d����Һ�У�c��Na+���T2c��CO32����+c��HCO3����
B.c����Һ�У�c��Na+����c��HCO3������c��CO32����
C.b����Һ�У�c��H+��=1��10��7molL��1
D.a����Һ�У�ˮ�������c��H+��=1��10��10molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ʵ��Ӧ�ã���������������ԭ�����͵���( )
A. ��ˮ��������ƽ��Br2+H2O ![]() HBr + HBrO��������AgNO3��Һ����Һ��ɫ��dz
HBr + HBrO��������AgNO3��Һ����Һ��ɫ��dz
B. �ϳɰ���ҵ��ʹ������ý������
C. �ñ���ʳ��ˮ��ȥ�������Ȼ�������
D. ��2HI��g��![]() H2(g)+I2(g)����������������䣬ͨ��������ʹƽ����ϵ��ɫ��dz
H2(g)+I2(g)����������������䣬ͨ��������ʹƽ����ϵ��ɫ��dz
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com