
【题目】完成下列各题
(1)铵态氮肥不稳定,受热易分解.写出氯化铵(NH4Cl)受热发生分解反应的化学方程式 .
(2)乙烯能使溴水褪色,生成1,2﹣二溴乙烷(CH2 Br﹣CH2 Br).写出该反应的化学方程式 .
科目:高中化学 来源: 题型:
【题目】下列关于细胞主要化学成分的叙述中,不正确的是 ( )
A. 动物乳汁中的乳糖和植物细胞中的纤维素都属于多糖
B. 胆固醇、维生素D都属于脂质
C. 脱氧核糖核酸是染色体的主要成分之一
D. 蛋白质的多样性与氨基酸的种类、数目和排列顺序等有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是产生和收集气体的实验装置,该装置适合于( ) 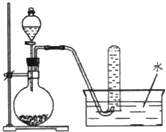
A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2
D.用NH4Cl溶液和Ca(OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
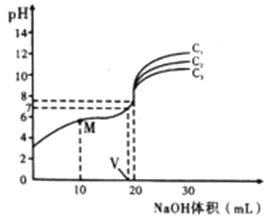
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 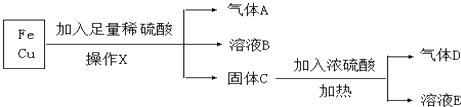
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高D.排除Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
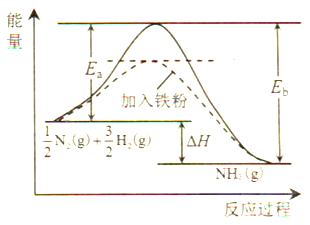
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。

①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种常见有机物之间的转化关系图。C具有果香味。

根据以上信息及各物质的转化关系完成下列各题:
(1)A的结构简式为_______,工业上用乙烯生产A的化学方程式为__________。
(2)B的官能团名称为_____,B可与纯碱溶液反应,写出该反应方程式_____________。
(3)A+B→C的化学方程式为__________,反应类型为_________反应。
(4)下列说法正确的是_______。
a.上述有机物中只有C6H12O6属于糖类物质
b.物质A和B都属于电解质
c.物质C和油脂类物质互为同系物
d.转化1可在人体内完成,该催化剂属于蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com